题目内容
17. 为了探索外界条件对反应2NO2(g)?N2O4(g)△H=-57kJ•mol-1的影响,若保持气体总质量不变,在温度为T1、T2时,通过实验得到平衡体系中NO2的体积分数随压强变化曲线,实验结果如图所示.下列说法正确的是( )
为了探索外界条件对反应2NO2(g)?N2O4(g)△H=-57kJ•mol-1的影响,若保持气体总质量不变,在温度为T1、T2时,通过实验得到平衡体系中NO2的体积分数随压强变化曲线,实验结果如图所示.下列说法正确的是( )| A. | a、c两点气体的平均相对分子质量:a>c | |
| B. | a、c两点气体的颜色:a浅,c深 | |
| C. | b、c两点的平衡常数:Kb=Kc | |
| D. | 状态a通过升高温度可变成状态b |
分析 2NO2(g)?N2O4(g)△H=-57kJ•mol-1,该反应为放热反应,升高温度,化学平衡逆向移动,NO2的体积分数增大;增大压强,化学平衡逆向移动,NO2的体积分数减小,结合图象来分析解答.
A、增大压强,化学平衡逆向移动,c点时气体的物质的量小,混合气体的总质量不变,据此判断;
B、增大压强平衡向逆反应进行,向逆反应进行是减小由于压强增大导致浓度增大趋势,但到达平衡仍比原平衡浓度大;
C、b、c两点的温度不同,平衡常数不同;
D、升高温度,化学平衡逆向移动,NO2的体积分数增大,由图象分析.
解答 解:A.由图象可知,a、c两点都在等温线上,c的压强大,增大压强,化学平衡逆向移动,c点时气体的物质的量小,混合气体的总质量不变,则平均相对分子质量大,即平均相对分子质量:a<c,故A错误;
B.由图象可知,a、c两点都在等温线上,c的压强大,与a相比c点平衡向逆反应进行,向逆反应进行是由于减小体积增大压强,平衡移动的结果降低NO2浓度增大趋势,但到达平衡仍比原平衡浓度大,平衡时NO2浓度比a的浓度高,NO2为红棕色气体,则a、c两点气体的颜色:a浅,c深,故B正确;
C.b、c两点的温度不同,平衡常数:Kb≠Kc,故C错误;
D.升高温度,化学平衡逆向移动,NO2的体积分数增大,由图象可知,a点NO2的体积分数大,则T1<T2,由状态b到状态a,可以用加热的方法,故D错误;
故选B.
点评 本题考查化学平衡的图象,明确外界条件对化学平衡的影响及图象中纵横坐标的含义、“定一议二”“先拐先平”原则即可解答,难度不大.注意B选项为易错点,改变压强的本质为体积变化.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案
相关题目
7.用水稀释0.1mol•L-1氨水时,溶液中随着水量的增加而减小的是( )
| A. | $\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$ | B. | c(OH-)•c(H+) | ||
| C. | c (OH-) | D. | H+的物质的量 |
8.实验室中用下列装置进行相应实验,能达到实验目的是( )
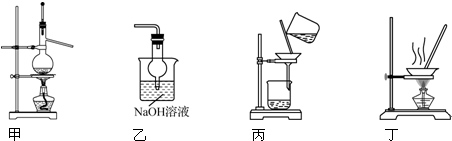

| A. | 用装置甲以乙醇和浓硫酸为原料制乙烯 | |
| B. | 用装置乙吸收某些实验尾气中的二氧化硫 | |
| C. | 用装置丙分离Cl2与KI溶液反应生成的碘 | |
| D. | 用装置丁蒸干NH4Cl饱和溶液获取NH4Cl晶体 |
5.雾霾严重影响人们的生活与健康.某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-.某同学收集了该地区的雾霾,经必要的预处理后得试样溶液,设计并完成了如下的实验:
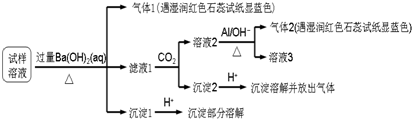
已知:3NO3-+8Al+5OH-+2H2O$\stackrel{△}{→}$3NH3+8AlO2-根据以上的实验操作与现象,该同学得出的结论不正确的是( )

已知:3NO3-+8Al+5OH-+2H2O$\stackrel{△}{→}$3NH3+8AlO2-根据以上的实验操作与现象,该同学得出的结论不正确的是( )
| A. | 试样中肯定存在NH4+、Mg2+、SO42-和NO3- | |
| B. | 试样中可能含有Al3+ | |
| C. | 该雾霾中可能存在NaNO3、NH4Cl和MgSO4 | |
| D. | 试样中不可能存在Na+、Cl- |
12.室温下,关于下列四种溶液的叙述中,正确的是( )
| 序号 | ① | ② | ③ | ④ |
| 溶液 | 氨水 | NaOH | CH3COOH | HCl |
| 浓度c/mol•L-1 | 0.01 | 0.01 | 0.01 | 0.01 |
| A. | 由水电离出的c(H+):①=②=③=④ | |
| B. | 溶液的pH:②>①>④>③ | |
| C. | ②、③混合呈中性,所需溶液的体积:③>② | |
| D. | ①、④等体积混合,所得溶液中离子的浓度:c(NH4+)=c(Cl-)>c(H+)=c(OH-) |
2.下列有关实验的叙述正确的是( )
| A. | 少量液溴、白磷和金属钠的保存均需用水封 | |
| B. | 容量瓶、滴定管在使用前均需用所装试剂润洗 | |
| C. | 苯和甲苯、乙醇和乙酸均可使用分液漏斗分离 | |
| D. | 除去氯化钠固体中的碘、除去碳酸钠固体中的碳酸氢钠,均可用加热的方法 |
7.用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极),下列说法正确的是( )
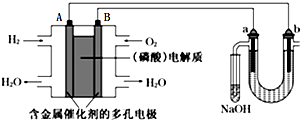

| A. | 电池工作时,B极反应式为O2+2H2O+4e-=4OH- | |
| B. | 电解时,电子流动路径是:A极→外电路→b极→溶液→a极→B极 | |
| C. | NaOH溶液充分吸收后所得溶液可制作漂白水 | |
| D. | 当电池中消耗2.24L(标准状况)H2时,a极周围也会产生2.24L(标准状况)气体 |


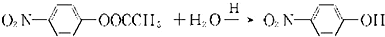 +CH3COOH.
+CH3COOH.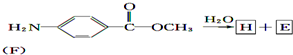
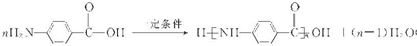 .
. 结构.
结构. .
.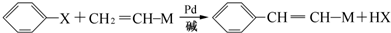
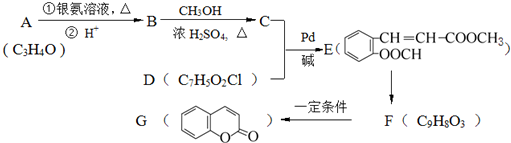

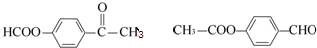
 )常用作香豆素的替代品.鉴别二氢香豆素和它的一种同分异构体(
)常用作香豆素的替代品.鉴别二氢香豆素和它的一种同分异构体( )需要用到的试剂有:NaOH溶液、稀硫酸、氯化铁溶液
)需要用到的试剂有:NaOH溶液、稀硫酸、氯化铁溶液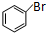 +CH2═CHCOOCH3$→_{碱}^{Pd}$
+CH2═CHCOOCH3$→_{碱}^{Pd}$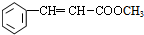 +HBr.
+HBr.