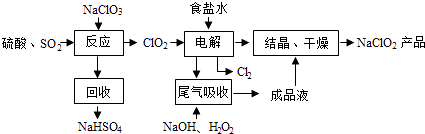
题目内容
【题目】As2O3在医药、电子等领域有重要应用。某含砷元素(As)的工业废水经如图1流程转化为粗产品。

(1)“碱浸”的目的是将废水中的H3AsO3和H3AsO4转化为盐。H3AsO4转化为Na3AsO4反应的化学方程式是_______________________________。
(2)“氧化”时,1molAsO33-转化为AsO43-至少需要O2______ mol。
(3)“沉砷”是将砷元素转化为Ca5(AsO4)3OH沉淀,发生的主要反应有:
a.Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq) △H<0
Ca2+(aq)+2OH-(aq) △H<0
b.5Ca2++OH-+3AsO43-![]() Ca5(AsO4)3OH △H>0
Ca5(AsO4)3OH △H>0
研究表明:“沉砷”的最佳温度是85℃。 用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因是_____________________。
(4)“还原”过程中H3AsO4转化为H3AsO3,反应的化学方程式是_______________________。
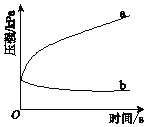
(5)“还原”后加热溶液,H3AsO3分解为As2O3,同时结晶得到粗As2O3。As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如图2所示。为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是_______。

(6)下列说法中,正确的是 ______ (填字母)。
a.粗As2O3中含有CaSO4
b.工业生产中,滤液2可循环使用,提高砷的回收率
c.通过先“沉砷”后“酸化”的顺序,可以达到富集砷元素的目的
【答案】 H3AsO4+3NaOH═Na3AsO4+3H2O 0.5 温度升高,反应a平衡逆向移动,c(Ca2+)下降,反应b平衡逆向移动,Ca5(AsO4)3OH沉淀率下降 H3AsO4+H2O+SO2═H3AsO3+H2SO4 调硫酸浓度约为7molL-1,冷却至25℃,过滤 abc
【解析】试题分析:(1)H3AsO4与氢氧化钠发生中和反应生成Na3AsO4;(2)根据电子守恒计算1molAsO33-转化为AsO43-至少需要O2的物质的量;(3)温度升高,Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq) △H<0,平衡逆向移动,c(Ca2+)、c(OH-)下降,所以反应b平衡逆向移动;(4)H3AsO4被SO2还原成H3AsO3;(5)根据图2,As2O3的溶解度在25℃、硫酸的浓度在7molL-1时最小;(6)CaSO4微溶于水;滤液2含有少量As2O3、硫酸;“沉砷”生成Ca5(AsO4)3OH可以富集砷元素;
Ca2+(aq)+2OH-(aq) △H<0,平衡逆向移动,c(Ca2+)、c(OH-)下降,所以反应b平衡逆向移动;(4)H3AsO4被SO2还原成H3AsO3;(5)根据图2,As2O3的溶解度在25℃、硫酸的浓度在7molL-1时最小;(6)CaSO4微溶于水;滤液2含有少量As2O3、硫酸;“沉砷”生成Ca5(AsO4)3OH可以富集砷元素;
解析:(1)H3AsO4与氢氧化钠发生中和反应生成Na3AsO4,反应方程式是H3AsO4+3NaOH═Na3AsO4+3H2O;(2)1molAsO33-转化为AsO43-失电子2mol,1mol氧气得电子4mol,根据电子守恒,需要O2的物质的量![]() ;(3)温度升高,Ca(OH)2(s)
;(3)温度升高,Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq) △H<0,平衡逆向移动,c(Ca2+)、c(OH-)下降,反应b平衡逆向移动,所以随温度升高沉淀率下降;(4)H3AsO4被SO2还原成H3AsO3反应的化学方程式是H3AsO4+H2O+SO2═H3AsO3+H2SO4;(5)根据图2,As2O3的溶解度在25℃、硫酸的浓度在7molL-1时最小,为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是调硫酸浓度约为7molL-1,冷却至25℃,过滤;(6)CaSO4微溶于水,钙离子未完全除去,所以粗As2O3中含有CaSO4,故a正确;滤液2含有少量As2O3、硫酸,滤液2可循环使用,提高砷的回收率,故b正确;“沉砷”生成Ca5(AsO4)3OH可以富集砷元素,故c正确。
Ca2+(aq)+2OH-(aq) △H<0,平衡逆向移动,c(Ca2+)、c(OH-)下降,反应b平衡逆向移动,所以随温度升高沉淀率下降;(4)H3AsO4被SO2还原成H3AsO3反应的化学方程式是H3AsO4+H2O+SO2═H3AsO3+H2SO4;(5)根据图2,As2O3的溶解度在25℃、硫酸的浓度在7molL-1时最小,为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是调硫酸浓度约为7molL-1,冷却至25℃,过滤;(6)CaSO4微溶于水,钙离子未完全除去,所以粗As2O3中含有CaSO4,故a正确;滤液2含有少量As2O3、硫酸,滤液2可循环使用,提高砷的回收率,故b正确;“沉砷”生成Ca5(AsO4)3OH可以富集砷元素,故c正确。

 黄冈天天练口算题卡系列答案
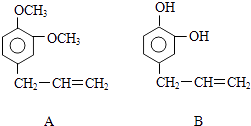
黄冈天天练口算题卡系列答案【题目】工业上采用氯化铵焙烧菱锰矿制备高纯度碳酸锰,工艺流程如下:
己知相关信息如下:
①菱猛矿的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②氢氧化物沉淀的条件:Al3+、Fe3+完全沉淀的pH分别为4.7、3 2;Mn2+、Mg2+开始沉淀的pH分别为8.1、9.1。
③“焙烧”过程的主要反应MnCO3+2NH4Cl=MnCl2+2NH3↑+CO2↑+H2O。
④常温下,几种难溶物的Ksp如下表所示:
难溶物 | Mn(OH)2 | MnCO3 | CaF2 | MgF2 |
Ksp | 2.0×10-13 | 2.0×10-11 | 2.0×10-10 | 7.0×10-11 |
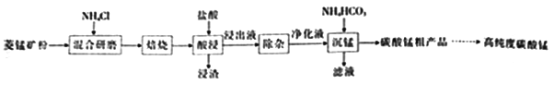
(1)分析图1、图2、图3,最佳的焙烧温度、焙烧时间、m(NH4Cl)/m(美锰矿粉)分别为____、____、____。
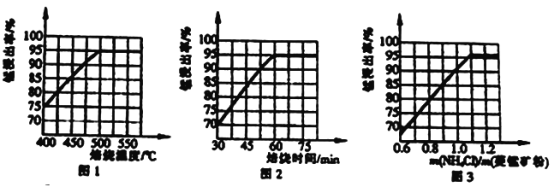
(2) “除杂”过程如下:
①已知几种氧化剂氧化能力的强弱顺序为(NH4)2S2O3>H2O2 >Cl 2>MnO2 >Fe2+,则氧化剂X宜选择_________(填字母)。
A. (NH4)2S2O3 B. MnO2 C. H2O2 D. Cl 2
②调节pH时,pH 可取的最低值为_____________。
③当CaF2、MgF2两种沉淀共存时,若溶液中c(Ca2+)=1.0×10-3mol/L,则c(Mg2+)=____mol/L。
(3)“沉锰”过程中,不用碳酸纳溶液替代NH4HCO3溶液,可能的原因是__________。
(4)测定碳酸锰粗产品的纯度。实验步骤:
①称取0.5000g碳酸锰粗产品于300mL锥形瓶中,加少量水湿润,再加25mL磷酸,移到通风橱内加热至240℃,停止加热,立即加入2 g硝酸铵,保温,充分反应后,粗产品中的碳酸锰全部转化为[Mn(PO4)2]3-,多余的硝酸铵全部分解。用氮气赶尽锥形瓶内的氮氧化物,冷却至室温。
②将上述锥形瓶中的溶液加水稀释至100mL,滴加2-3滴指示剂,然后用浓度为0.2000mol/L的硫酸亚铁铵[(NH4)Fe(SO4)2]标准溶液滴定,发生的反应为[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO43-。到达滴定终点时,消耗的硫酸亚铁铵标准溶液的体积为20.00mL。
计算:碳酸锰粗产品的纯度=___________。
误差分析:若滴定终点时发现滴定管尖嘴处产生了气泡,则测得的碳酸锰粗产品的纯度_____(填“偏高”“偏低”或 “无影响”)。
【题目】以黄铜矿(主要成分二硫化亚铁铜CuFeS2)为原料,用Fe2(SO4)3溶液作浸取剂提取铜,总反应的离子方程式是CuFeS2 + 4Fe3+ ![]() Cu2+ + 5Fe2+ + 2S。
Cu2+ + 5Fe2+ + 2S。
(1)该反应中,Fe3+体现________性。
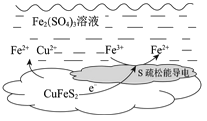
(2)上述总反应的原理如图所示。
负极的电极反应式是________。
(3)一定温度下,控制浸取剂pH = 1,取三份相同质量黄铜矿粉末分别进行如下实验:
实验 | 操作 | 2小时后Cu2+浸出率/% |
I | 加入足量0.10 mol·L-1 Fe2(SO4)3溶液 | 78.2 |
II | 加入足量0.10 mol·L-1 Fe2(SO4)3溶液,通入空气 | 90.8 |
III | 加入足量0.10 mol·L-1 Fe2(SO4)3溶液,再加入少量0.0005 mol·L-1 Ag2SO4溶液 | 98.0 |
①对比实验I、II,通入空气,Cu2+浸出率提高的原因是________。
②由实验III推测,在浸取Cu2+过程中Ag+作催化剂,催化原理是:
ⅰ.CuFeS2+4Ag+==Fe2++Cu2++2Ag2S
ⅱ.Ag2S+2Fe3+==2Ag++2Fe2++S
为证明该催化原理,进行如下实验:
a.取少量黄铜矿粉末,加入少量0.0005 mol·L-1 Ag2SO4溶液,充分混合后静置。取上层清液,加入稀盐酸,观察到溶液中________,证明发生反应i。
b.取少量Ag2S粉末,加入________溶液,充分混合后静置。取上层清液,加入稀盐酸,有白色沉淀,证明发生反应ii。
(4)用实验II的浸取液电解提取铜的原理如图所示:
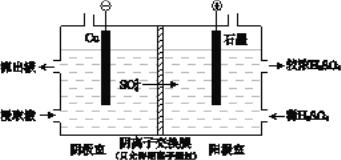
① 电解初期,阴极没有铜析出。用电极反应式解释原因是_______________。
② 将阴极室的流出液送入阳极室,可使浸取剂再生,再生的原理是 _____________________。