题目内容
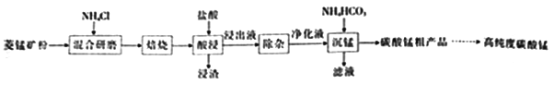
【题目】工业上采用氯化铵焙烧菱锰矿制备高纯度碳酸锰,工艺流程如下:
己知相关信息如下:
①菱猛矿的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②氢氧化物沉淀的条件:Al3+、Fe3+完全沉淀的pH分别为4.7、3 2;Mn2+、Mg2+开始沉淀的pH分别为8.1、9.1。
③“焙烧”过程的主要反应MnCO3+2NH4Cl=MnCl2+2NH3↑+CO2↑+H2O。
④常温下,几种难溶物的Ksp如下表所示:
难溶物 | Mn(OH)2 | MnCO3 | CaF2 | MgF2 |
Ksp | 2.0×10-13 | 2.0×10-11 | 2.0×10-10 | 7.0×10-11 |
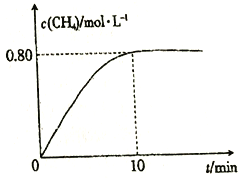
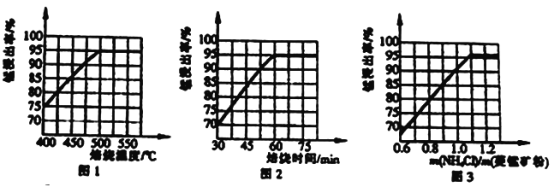
(1)分析图1、图2、图3,最佳的焙烧温度、焙烧时间、m(NH4Cl)/m(美锰矿粉)分别为____、____、____。
(2) “除杂”过程如下:
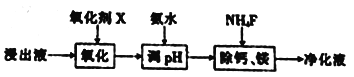
①已知几种氧化剂氧化能力的强弱顺序为(NH4)2S2O3>H2O2 >Cl 2>MnO2 >Fe2+,则氧化剂X宜选择_________(填字母)。
A. (NH4)2S2O3 B. MnO2 C. H2O2 D. Cl 2
②调节pH时,pH 可取的最低值为_____________。
③当CaF2、MgF2两种沉淀共存时,若溶液中c(Ca2+)=1.0×10-3mol/L,则c(Mg2+)=____mol/L。
(3)“沉锰”过程中,不用碳酸纳溶液替代NH4HCO3溶液,可能的原因是__________。
(4)测定碳酸锰粗产品的纯度。实验步骤:
①称取0.5000g碳酸锰粗产品于300mL锥形瓶中,加少量水湿润,再加25mL磷酸,移到通风橱内加热至240℃,停止加热,立即加入2 g硝酸铵,保温,充分反应后,粗产品中的碳酸锰全部转化为[Mn(PO4)2]3-,多余的硝酸铵全部分解。用氮气赶尽锥形瓶内的氮氧化物,冷却至室温。
②将上述锥形瓶中的溶液加水稀释至100mL,滴加2-3滴指示剂,然后用浓度为0.2000mol/L的硫酸亚铁铵[(NH4)Fe(SO4)2]标准溶液滴定,发生的反应为[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO43-。到达滴定终点时,消耗的硫酸亚铁铵标准溶液的体积为20.00mL。
计算:碳酸锰粗产品的纯度=___________。
误差分析:若滴定终点时发现滴定管尖嘴处产生了气泡,则测得的碳酸锰粗产品的纯度_____(填“偏高”“偏低”或 “无影响”)。
【答案】 500℃ 60min 1.1 B 4.7 3.5×10-6 碳酸钠溶液中的c(OH-)较大,会产生Mn(OH)2沉淀 92.00% 偏低
【解析】(1)图1随着温度升高锰浸出率增大,到500℃达最高为95%,图2随着时间的增大,锰浸出率增大,到60min达最大为95%,图3随着m(NH4Cl)/m(美锰矿粉)增大,锰浸出率增大,到1.1达最大为95%,最佳的焙烧温度、焙烧时间、m(NH4Cl)/m(美锰矿粉)分别为500℃、60min、1.1;(2)①已知几种氧化剂氧化能力的强弱顺序为(NH4)2S2O3>H2O2>Cl2>MnO2>Fe2+,氧化剂X的加入是为了将亚铁离子氧化为铁离子,铁离子水解产生氢氧化铁而除去,试剂的加入不能引入新的杂质,宜选择MnO2,反应产生锰离子,且过量时不溶可随沉淀过滤除去,答案选B;②调节pH时,是为了除去氧化后溶液中的Al3+、Fe3+,必须使Al3+、Fe3+完全沉淀,则pH可取的最低值为4.7;③当CaF2、MgF2两种沉淀共存时,若溶液中c(Ca2+)=1.0×10-3mol/L,则c2(F-)= =
=![]() =2.0×10-7,c(Mg2+)=
=2.0×10-7,c(Mg2+)=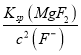 =
=![]() =3.5×10-6mol/L;(3)碳酸钠溶液中的c(OH-)较大,会产生Mn(OH)2沉淀,故“沉锰”过程中,不用碳酸纳溶液替代NH4HCO3溶液;(4)①设碳酸锰粗产品的纯度为x,根据锰原子守恒及反应[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO43-可得关系式为:
=3.5×10-6mol/L;(3)碳酸钠溶液中的c(OH-)较大,会产生Mn(OH)2沉淀,故“沉锰”过程中,不用碳酸纳溶液替代NH4HCO3溶液;(4)①设碳酸锰粗产品的纯度为x,根据锰原子守恒及反应[Mn(PO4)2]3-+Fe2+=Mn2++Fe3++2PO43-可得关系式为:
MnCO3~~~~~ Mn2+~~~~~~~ Fe2+~~~~~~~~~(NH4)Fe(SO4)2
115g 1mol
0.5000xg 0.2000mol/L×20.00mL×10-3L/mL=4.0×10-3 mol
![]() =
=![]() ,解得x=92.00%;若滴定终点时发现滴定管尖嘴处产生了气泡,则所用标准液的体积读数偏小,根据c(待测)=
,解得x=92.00%;若滴定终点时发现滴定管尖嘴处产生了气泡,则所用标准液的体积读数偏小,根据c(待测)=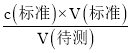 可知,测得的碳酸锰粗产品的纯度偏低。
可知,测得的碳酸锰粗产品的纯度偏低。

【题目】用如图装置实验,下列实验现象预期及相应结论均正确的是( )
a | b | 实验现象预期 | 结论 | |
A | 铜丝 | 浓硝酸 | 试管c中有大量红棕色气体 | 硝酸有强氧化性 |
B | 木条 | 18.4mol/L硫酸 | 木条变黑 | 浓硫酸有酸性及氧化性 |
C | 生铁 | NaCl溶液 | 导管处发生倒吸 | 生铁发生吸氧腐蚀 |
D | 铁丝 | 含少量HCl的H2O2溶液 | 试管c中有大量无色气体 | 该反应中铁作催化剂 |

A.A
B.B
C.C
D.D