题目内容
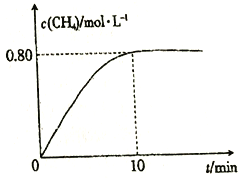
【题目】生铁在pH=2和pH=4的盐酸中发生腐蚀.在密闭容器中,用压强传感器记录该过程的压强变化,如图所示.下列说法中,不正确的是( )
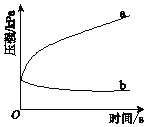
A. 两容器中负极反应均为Fe-2e-═Fe2+
B. 曲线a记录的是pH=2的盐酸中压强的变化
C. 曲线b记录的容器中正极反应是O2+4e-+2H2O═4OH-
D. 在弱酸性溶液中,生铁能发生吸氧腐蚀
【答案】C
【解析】生铁在pH=2和pH=4的盐酸中构成原电池,铁是负极,铁失电子生成Fe2+,故A正确;根据图像,曲线a压强逐渐增大,气体增多,说明有氢气生成,所以曲线a记录的是pH=2的盐酸中压强的变化,故B正确;根据图像,曲线b压强逐渐减小,气体减少,说明氧气在正极得电子,pH=4溶液呈酸性,曲线b记录的容器中正极反应是O2+4e-+4H+═2H2O,故C错误;在强酸性溶液中发生析氢腐蚀,在弱酸性溶液中,正极是氧气得电子,生铁发生吸氧腐蚀,故D正确。

 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案【题目】某化学小组研究盐酸被氧化的条件,进行如下实验.
(1)研究盐酸被MnO2氧化.
实验 | 操作 | 现象 |
I | 常温下将MnO2和12molL-1浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
II | 将 I中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
III | 加热MnO2和4molL-1稀盐酸混合物 | 无明显现象 |
①已知MnO2呈弱碱性.I中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是______.
②II中发生了分解反应,反应的化学方程式是______.
③III中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验(图1)IV进行探究:

将实验 III、IV作对比,得出的结论是______;将 i、ii作对比,得出的结论是______.
④用图2装置(a、b均为石墨电极)进行实验 V:
ⅰ.K闭合时,指针向左偏转
ⅱ.向右管中滴加浓H2SO4至c(H+)≥7molL-1,指针偏转幅度变化不大
ⅲ.再向左管中滴加浓H2SO4至c(H+)≥7molL-1,指针向左偏转幅度增大
将ⅰ和ⅱ、ⅲ作对比,得出的结论是______.
(2)研究盐酸能否被氧化性酸氧化.
①烧瓶中放入浓H2SO4,通过分液漏斗向烧瓶中滴加浓盐酸,烧瓶上方立即产生白雾,用湿润的淀粉KI试纸检验,无明显现象.由此得出浓硫酸______(填“能”或“不能”)氧化盐酸.
②向试管中加入3mL浓盐酸,再加入1mL浓HNO3,试管内液体逐渐变为橙色,加热,产生棕黄色气体,经检验含有NO2.
实验 | 操作 | 现象 |
I | 将湿润的淀粉KI试纸伸入棕黄色气体中 | 试纸先变蓝,后褪色 |
II | 将湿润的淀粉KI试纸伸入纯净Cl2中 | 试纸先变蓝,后褪色 |
III | … | … |
通过实验I、II、III证明混合气体中含有Cl2,III的操作是______.
(3)由上述实验得出:盐酸能否被氧化与氧化剂的种类、______有关.