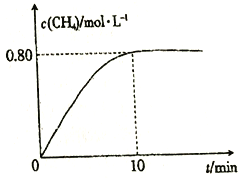
题目内容
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下: 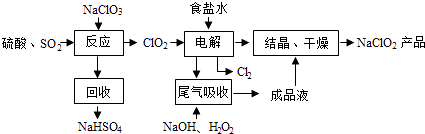
回答下列问题:
(1)NaClO2中Cl的化合价为 .
(2)写出“反应”步骤中生成ClO2的化学方程式 .
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+ , 要加入的试剂分别为、 . “电解”中阴极反应的主要产物是 .
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2 . 此吸收反应中,氧化剂与还原剂的物质的量之比为 , 该反应中氧化产物是 .
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力.NaClO2的有效氯含量为 . (计算结果保留两位小数)
【答案】
(1)+3价
(2)2NaClO3+SO2+H2SO4=2NaHSO4+2ClO2
(3)NaOH溶液;Na2CO3溶液;ClO2﹣(或NaClO2)
(4)2:1;O2
(5)1.57
【解析】解:(1.)在NaClO2中Na为+1价,O为﹣2价,根据正负化合价的代数和为0,可得Cl的化合价为+3价,所以答案是:+3;
(2.)NaClO3和SO2在H2SO4酸化条件下生成ClO2 , 其中NaClO2是氧化剂,还原产物为NaCl,回收产物为NaHSO4 , 说明生成硫酸氢钠,且产生ClO2 , 根据电子守恒可知,此反应的化学方程式为:2NaClO3+SO2+H2SO4=2NaHSO4+2ClO2 , 所以答案是:2NaClO3+SO2+H2SO4=2NaHSO4+2ClO2;
(3.)食盐溶液中混有Mg2+ 和Ca2+ , 可以利用过量NaOH溶液除去Mg2+ , 利用过量Na2CO3溶液除去Ca2+ , ClO2氧化能力强,根据结晶干燥后的产物可知ClO2的还原产物为NaClO2 , 因此电解装置中阴极ClO2得电子生成ClO2﹣ , 阳极Cl﹣失电子生成Cl2 . 所以答案是:NaOH溶液;Na2CO3溶液;ClO2﹣(或NaClO2);
(4.)依据图示可知,利用含过氧化氢的氢氧化钠溶液吸收ClO2 , 产物为ClO2﹣ , 则此反应中ClO2为氧化剂,还原产物为ClO2﹣ , 化合价从+4价降为+3价,H2O2为还原剂,氧化产物为O2 , 每摩尔H2O2得到2mol电子,依据电子守恒可知氧化剂和还原剂的物质的量之比为2:1,所以答案是:2:1;O2;
(5.)1gNaClO2的物质的量 ![]() =
= ![]() mol,依据电子转移数目相等,NaClO2~Cl﹣~4e﹣ , Cl2~2Cl﹣~2e﹣ , 可知氯气的物质的量为
mol,依据电子转移数目相等,NaClO2~Cl﹣~4e﹣ , Cl2~2Cl﹣~2e﹣ , 可知氯气的物质的量为 ![]() mol×4×
mol×4× ![]() =
= ![]() mol,则氯气的质量为
mol,则氯气的质量为 ![]() mol×71g/mol=1.57g,所以答案是:1.57g.
mol×71g/mol=1.57g,所以答案是:1.57g.

 特高级教师点拨系列答案
特高级教师点拨系列答案【题目】用如图装置实验,下列实验现象预期及相应结论均正确的是( )
a | b | 实验现象预期 | 结论 | |
A | 铜丝 | 浓硝酸 | 试管c中有大量红棕色气体 | 硝酸有强氧化性 |
B | 木条 | 18.4mol/L硫酸 | 木条变黑 | 浓硫酸有酸性及氧化性 |
C | 生铁 | NaCl溶液 | 导管处发生倒吸 | 生铁发生吸氧腐蚀 |
D | 铁丝 | 含少量HCl的H2O2溶液 | 试管c中有大量无色气体 | 该反应中铁作催化剂 |

A.A
B.B
C.C
D.D