题目内容
17.用NA表示阿伏加德罗常数的值.下列判断正确的是( )| A. | 常温常压下,44gCO2中含有的氧原子数目为2NA | |
| B. | 标准状况下,22.4LH2O含有的分子数目为NA | |
| C. | 1mol•L-1K2SO4溶液中含有的钾离子数目为2NA | |
| D. | 1molFe在足量的Cl2中完全燃烧,转移的电子数目为2NA |
分析 A、求出二氧化碳的物质的量,然后根据1mol二氧化碳中含2mol氧原子来计算;
B、标况下,水为液态;
C、溶液体积不明确;
D、根据铁反应后变为+3价来分析.
解答 解:A、44g二氧化碳的物质的量为1mol,而1mol二氧化碳中含2mol氧原子,故A正确;
B、标况下,水为液态,不能利用Vm计算物质的量,故B错误;
C、溶液体积不明确,故溶液中钾离子的个数无法计算,故C错误;
D、铁反应后变为+3价,故1mol铁失去3mol电子,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
7.下列说法或表达正确的是( )
| A. | 石油是混合物,其分馏产品汽油也是混合物 | |
| B. | NH4I的电子式: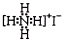 | |
| C. | 糖类、蛋白质和乙酸都是人体必需的营养物质 | |
| D. | 陶瓷、水晶、水泥、玻璃都属于硅酸盐 |
8.下列物质中,属于电解质的是( )
| A. | 水银 | B. | 硝酸钾 | C. | 酒精 | D. | 蔗糖 |
5.二氧化硫不具有的性质是( )
| A. | 无色无味 | B. | 漂白性 | C. | 还原性 | D. | 会形成酸雨 |
12.2SO2+O2?2SO3△H<0是工业上接触法制硫酸的重要反应.下列关于该反应的说法不正确的是( )
| A. | 增加O2的浓度提高SO2的转化率 | |
| B. | 利用该反应放出的热量对SO2、O2预热 | |
| C. | 降低温度能加快反应的速率 | |
| D. | 即使增大压强也不能使SO2全部转化为SO3 |
2.下列有机化学反应方程式书写及反应类型均正确的是( )
| A. | CH2=CH2+HCl$\stackrel{催化剂}{→}$CH3CH2Cl 加聚反应 | |
| B. | CH3COOH+CH3CH2OH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O 酯化反应 | |
| C. | 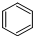 +Br2 $\stackrel{FeBr_{3}}{→}$ +Br2 $\stackrel{FeBr_{3}}{→}$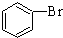 +HBr 加成反应 +HBr 加成反应 | |
| D. | 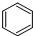 +HNO3$→_{50~60℃}^{浓H_{2}SO_{4}}$ +HNO3$→_{50~60℃}^{浓H_{2}SO_{4}}$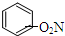 +H2O 取代反应 +H2O 取代反应 |
9.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,18 g H20所含的中子数为10NA | |
| B. | 一定条件下1 mol铁粉与浓硫酸反应,转移电子数一定为3NA | |
| C. | 在1 L的碳酸钠溶液中,若c(CO32一)=1 mol•L-1,则Na+数目大于2NA | |
| D. | 含阴阳离子总数为4NA的固体Na202溶于水配成1 L溶液,所得溶液中Na+的物质的量浓度为2 mol•L-1 |
6.25℃时,100mL 0.1mol/L的三种盐溶液NaX、NaY、NaZ的pH分别为7、8、9,则下列说法正确的是( )
| A. | 三种溶液中,相关微粒存在如下关系:c(X-)=c(Y-)+c(HY)=c(Z-)+c(HZ) | |
| B. | 三种溶液中离子浓度c(X-)<c(Y-)<c(Z-) | |
| C. | 将三种溶液均加水稀释到1000mL后,三种溶液的pH分别为8、9、10 | |
| D. | HX、HY、HZ的酸性依次增强,电离平衡常数K(HX)>K(HY)>K(HZ) |
7.${\;}_{\;}^{37}$Cl、${\;}_{\;}^{35}$Cl为不同的核素,下列说法正确的是( )
| A. | ${\;}_{\;}^{37}$Cl2的摩尔质量是74 | |
| B. | 通常情况下,氯气做氧化剂,但氯气也具有还原性 | |
| C. | 35克的${\;}_{\;}^{35}$Cl2含有电子17mol | |
| D. | 常温下,4.48L ${\;}_{\;}^{37}$Cl2含有8NA 个中子(NA 为阿伏加德罗常数) |