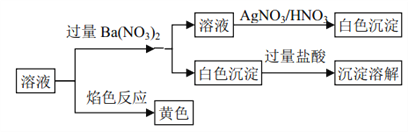
题目内容
【题目】如图是元素周期表的一部分 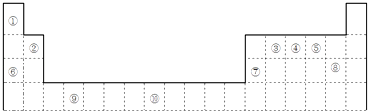
(1)元素⑩的次外层电子数为个.
(2)如果在温度接近373K时,根据M=m/n测定⑤的气态氢化物的相对分子质量,结果发现测定结果比理论值高,其原因是;
(3)某些不同族元素的性质也有一定的相似性,如上表中元素⑦与元素②的氢氧化物有相似的性质.写出元素②的氢氧化物与NaOH溶液反应的离子方程式;
(4)根据下列五种元素的第一至第四电离能数据(单位:kJmol﹣1),回答下面各题:
元素代号 | I1 | I2 | I3 | I4 |
Q | 2080 | 4000 | 6100 | 9400 |
R | 500 | 4600 | 6900 | 9500 |
S | 740 | 1500 | 7700 | 10500 |
T | 580 | 1800 | 2700 | 11600 |
U | 420 | 3100 | 4400 | 5900 |
①在周期表中,最可能处于同一主族的是 . (填元素代号)
②T元素最可能是(填“s”、“p”、“d”、“ds”等)区元素;若T为第二周期元素,Z是第三周期元素中原子半径最小的主族元素,则T、Z形成的化合物分子键角为 .
【答案】
(1)14
(2)分子间存在氢键,H2O分子发生缔合
(3)2OH﹣+Be(OH)2=BeO22﹣+2H2O
(4)R和U;p;120°
【解析】解:由元素在周期表中位置,可知①为H、②为Be、③为C、④为N、⑤为O、⑥为Na、⑦为Al、⑧为Cl、⑨为Ti、⑩为Fe.
(1.)元素⑩为Fe,核外电子排布为1s22s22p63s23p63d64s2 , 次外层电子排布为3s23p63d6 , 次外层电子数为14,所以答案是:14;
(2.)分子间存在氢键,H2O分子发生缔合,相对分子质量测定结果比理论值高,所以答案是:分子间存在氢键,H2O分子发生缔合;
(3.)元素②的氢氧化物为Be(OH)2 , 与氢氧化铝性质相似,Be(OH)2与NaOH溶液反应生成NaBeO2与水,反应离子方程式为:2OH﹣+Be(OH)2=BeO22﹣+2H2O,所以答案是:2OH﹣+Be(OH)2=BeO22﹣+2H2O;
(4.)由元素的电离能可以看出,Q的电离能很大,可能为零族元素,R和U的第一电离能较小,第二电离能剧增,故表现+1价,最外层电子数为1,二者位于同一族,S的第一、第二电离能较小,第三电离能剧增,故表现+2价,最外层电子数为2,T的第一、第二、第三电离能较小,第四电离能剧增,表现+3价,最外层电子数为3.①由上述分析可知,R和U的第一电离能较小,第二电离能剧增,故表现+1价,最外层电子数为1,二者位于同一族,所以答案是:R和U;②T元素第四电离能剧增,最外层电子数为3,外围电子排布为ns2np1 , 处于周期表中p区,若T为第二周期元素,则T为B元素,Z是第三周期元素中原子半径最小的主族元素,则Z为Cl,二者形成化合物为BCl3 , B原子形成3个B﹣Cl键,不含孤电子对,为平面正三角形结构,键角为:120°,所以答案是:p;120°.

 亮点激活精编提优100分大试卷系列答案
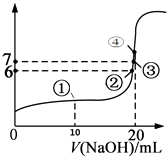
亮点激活精编提优100分大试卷系列答案【题目】滴定法是化学上常用的定量分析的方法.滴定的方法有酸碱中和滴定、氧化还原滴定、沉淀滴定、络合滴定等.
(1)甲化学兴趣小组取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用0.2000molL﹣1的标准NaOH溶液进行滴定.重复上述滴定操作3次,并记录数据.
a.滴定时边滴边摇动锥形瓶,眼睛应观察 . (填序号)
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
b.判断滴定终点的现象是: .
c.根据下列数据:请计算待测盐酸溶液的浓度为 mol/L.
滴定次数 | 待测液体积(mL) | 标准NaOH溶液读数记录(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 4.00 | 24.00 |
第三次 | 20.00 | 2.00 | 24.10 |
(2)乙化学兴趣小组利用氧化还原反应滴定,测定了某工厂废水中游离态氯的含量.实验如下:
①取水样10.0ml于锥形瓶中,加入10.0ml的KI溶液(足量),滴入指示剂2~3滴.
②将自己配制的0.01molL﹣1标准Na2S2O3溶液装入滴定管中,调整液面,记下读数.
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3=2NaI+2Na2S4O6 . 试回答下列问答:
a.步骤①发生的化学反应方程式为:;加入的指示剂是 .
b.步骤②应使用式滴定管.
c.氯的所测浓度比实际浓度会偏大,造成误差的原因可能是(填序号)
A 配制标准Na2S2O3溶液定容时,加水超过刻度线
B 锥形瓶水洗后直接装待测水样
C 装标准Na2S2O3溶液的滴定管水洗后没有润洗
D 滴定到达终点时,俯视读出滴定管读数;
E 滴定前尖嘴部分有气泡,滴定后消失
(3)沉淀滴定所用的指示剂本身就是一种沉淀剂.已知一些银盐的颜色和Ksp(20℃)如下表,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定.
化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
Ksp | 2.0×10﹣10 | 5.4×10﹣13 | 8.3×10﹣17 | 2.0×10﹣48 | 2.0×10﹣12 |
a.滴定时,你认为该滴定适宜选用的指示剂是下列中的 . (填序号)
A.KBrB.KIC.K2S D.K2CrO4
b.向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时, ![]() = .
= .
【题目】已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理.请回答下列问题:
(1)常温下,浓度均为0.1molL﹣1的下列六种溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
①上述盐溶液中的阴离子,结合质子能力最强的是
②根据表中数据判断,浓度均为0.01molL﹣1的下列五种物质的溶液中,酸性最强的是;(填编号,下同)将各溶液分别稀释100倍,pH变化最小的是
A.HCN B.HClO C.C6H5OH D.CH3COOH E.H2CO3
③据上表数据,请你判断下列反应不能成立的是(填编号).
A.CH3COOH+Na2CO3═NaHCO3+CH3COONa
B.CH3COOH+NaCN═CH3COONa+HCN
C.CO2+H2O+2NaClO═Na2CO3+2HClO
D.CO2+H2O+2C6H5ONa═Na2CO3+2C6H5OH
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为
(2)CaCO3是一种难溶物质,其KSp=2.8×10﹣9 . 现将浓度为2×10﹣4 mol/L Na2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为 mol/L.