题目内容
8.(填序号)下列物质中,A、硫酸钡 B、浓硫酸 C、酒精溶液 D、氢氧化钠E、铜 F、蔗糖 G、氨气 H、硝酸钠溶液(1)属于电解质的是AD,
(2)属于非电解质的是FG.
分析 在水溶液或熔融状态下能够导电的化合物为电解质,在水溶液和熔融状态下都不能达到的化合物为非电解质,据此解答.
解答 解:A、硫酸钡是盐,熔融状态下能导电,属于电解质;
B、浓硫酸是混合物,既不是电解质也不是非电解质;
C、酒精溶液不能导电,属于混合物,既不是电解质也不是非电解质;
D、氢氧化钠是碱,属于电解质;
E、铜是金属单质,既不是电解质也不是非电解质;
F、蔗糖不能导电,属于非电解质;
G、氨气不能导电,属于非电解质;
H、硝酸钠溶液,是混合物,既不是电解质也不是非电解质,
故答案为:(1)AD; (2)FG.
点评 本题考查了电解质与非电解质的概念,题目难度不大,注意掌握电解质与非电解质的概念及判断方法,明确无论电解质还是非电解质,都一定为化合物.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
18.某学生设计了如图的方法对A盐进行鉴定:由此分析,下列结论中,正确的是( )
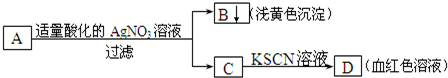

| A. | A中一定有Fe2+ | B. | B为AgI沉淀 | ||
| C. | A中可能有Fe3+ | D. | A一定为FeBr2溶液 |
 实验室常用MnO2与浓盐酸反应制备Cl2(发生装置如图所示).
实验室常用MnO2与浓盐酸反应制备Cl2(发生装置如图所示). .
. ;此固体所含化学键类型为离子键、共价键;此固体与AB2反应的化学方程式是:2Na2O2+2CO2=2Na2CO3+O2.
;此固体所含化学键类型为离子键、共价键;此固体与AB2反应的化学方程式是:2Na2O2+2CO2=2Na2CO3+O2. 如图是中学化学中常见的实验装置.
如图是中学化学中常见的实验装置. 碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下: