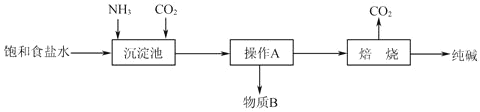
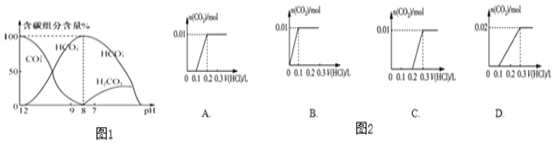
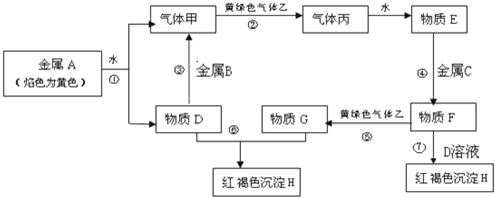
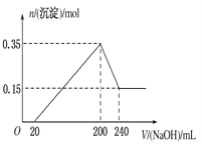
题目内容
【题目】现有下列十种物质:①液态氯化氢;②小苏打;③固体纯碱;④二氧化碳;⑤葡萄糖;⑥氢氧化钾;⑦氢氧化铁胶体;⑧氨水;⑨空气;⑩硫酸铁溶液。
(1)上述十种物质中,属于电解质的___________,属于非电解质的有____________。
(2)有两种物质在水溶液中可发生反应,离子方程式为:H+ + OH- = H2O,该反应的化学方程式为________。
(3)除去③中少量②的操作是___________,化学方程式为__________。
(4)现有10mL⑩溶液中含Fe3+ 5.6g,则溶液中SO42-的物质的量浓度是____________。
(5)若在⑦中缓慢加入①的水溶液,产生的现象是_____________________。
【答案】①②③⑥ ④⑤ HCl + KOH = KCl + H2O 加热 2NaHCO3![]() Na2CO3+CO2↑+H2O 1.5mol/L 先产生红褐色沉淀后沉淀溶解,溶液变黄色
Na2CO3+CO2↑+H2O 1.5mol/L 先产生红褐色沉淀后沉淀溶解,溶液变黄色
【解析】
(1)溶于水或在熔融状态下能够自身电离出离子的化合物是电解质,溶于水和在熔融状态下都不能够自身电离出离子的化合物是非电解质;
(2) H++OH-=H2O是强酸和强碱反应且生成可溶性盐和水的离子方程式;
(3)碳酸氢钠受热易分解生成碳酸钠;
(4)根据硫酸铁的化学式可知硫酸根的物质的量;
(5)胶体中加入电解质,先发生聚沉,再加入电解质HCl, 由于是酸碱中和反应,沉淀又溶解。
(1)溶于水或在熔融状态下能够自身电离出离子的化合物是电解质,因此属于电解质的有液态氯化氢、小苏打、固体纯碱、氢氧化钾;溶于水和在熔融状态下都不能够自身电离出离子的化合物是非电解质,因此属于非电解质的有二氧化碳、蔗糖;
答案为①②③⑥;④⑤;
(2)有两种物质在水溶液中可发生反应,离子方程式为H++OH-=H2O,这说明应该是强酸和强碱反应且生成可溶性盐,则该反应的化学方程式为HCl + KOH = KCl + H2O;
(3)碳酸氢钠受热易分解生成碳酸钠,则除去③中少量②的操作是加热,反应的化学方程式为2NaHCO3![]() Na2CO3+CO2↑+H2O;
Na2CO3+CO2↑+H2O;
(4) 5.6g铁离子的物质的量是0.1mol,则根据硫酸铁的化学式可知硫酸根的物质的量是0.15mol,浓度是![]() =1.5mol/L;
=1.5mol/L;
(5) 若在⑦氢氧化铁胶体中缓慢加入①液态氯化氢的水溶液,胶体中加入电解质,先发生聚沉,再加入电解质HCl,由于是酸碱中和反应,沉淀又溶解,溶液变为黄色,故答案为:先产生红褐色沉淀后沉淀溶解,溶液变黄色。