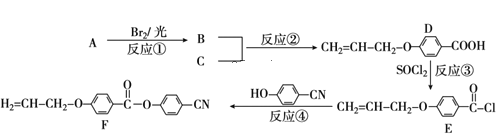
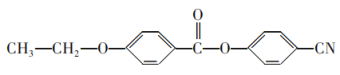
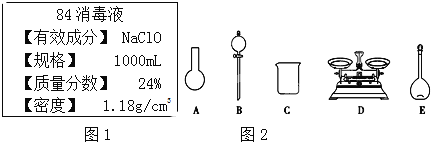
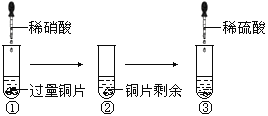
题目内容
【题目】盐酸和醋酸是生产、生活和化学实验中常见的酸。请回答:
(1)人的胃液中含有盐酸,经测定某人胃液的pH为2.0,则其中的c(H+)=___moL。
(2)食醋常用于食品调味,其主要成分为醋酸。醋酸的电离方程式为____。
(3)室温下,pH均为3的盐酸和醋酸溶液,下列各项中相等的是__(填编号)。
①溶液中的c(H+) ②酸的物质的量浓度 ③完全中和时,消耗NaOH的物质的量
【答案】0.01 CH3COOH![]() CH3COO-+H+ ①
CH3COO-+H+ ①
【解析】
(1)根据c(H+)=10-pH计算;
(2)醋酸是弱电解质,在水溶液里部分电离出醋酸根离子与氢离子;
(3)氯化氢是强电解质,醋酸是弱电解质,pH相等的盐酸和醋酸,醋酸的浓度大于盐酸;
(1)c(H+)=10-pH=10-2 mol·L-1;
(2)醋酸是弱电解质,在水溶液里部分电离,电离方程式为:CH3COOH![]() CH3COO-+H+ ;
CH3COO-+H+ ;
(3)氯化氢是强电解质,醋酸是弱电解质,pH相等的盐酸和醋酸,醋酸的浓度大于盐酸,
①溶液的pH相等,溶液中c(H+) 相等,故①正确;
②醋酸的浓度大于盐酸,故②错误;
③醋酸的浓度大于盐酸,中和等体积的两种酸溶液所需NaOH的质量醋酸大于盐酸,故③错误;
故选①;

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目