题目内容
【题目】用如图实验装置探究铜丝与过量浓硫酸的反应及SO2的部分化学性质。
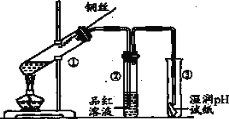
(1)试管①中发生反应的化学反应方程式为_____________________。
(2)装置③证明SO2溶液显__________性,同时证明SO2_________(填“能”或“不能”)漂白pH试纸。
(3)实验完毕,取下试管②并加热,可观察的现象是____________,该实验可以达到的目的是_______。
(4)实验初期发现大试管内有白色沉淀生成,该沉淀的化学式为_____________。
(5)终止试管①中反应的方法是_____________。
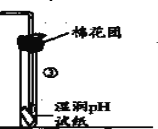
(6)基于环境保护的考虑,如图是某学生提出的实验改进方法,其中棉花团上应浸取的试剂为_________(任填一种)。
【答案】Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 酸 不能 溶液由无色恢复为红色 说明二氧化硫与有色物质生成的无色物质是不稳定的 CuSO4 停止加热或把铜丝抽离浓硫酸 NaOH溶液或高锰酸钾溶液
CuSO4+SO2↑+2H2O 酸 不能 溶液由无色恢复为红色 说明二氧化硫与有色物质生成的无色物质是不稳定的 CuSO4 停止加热或把铜丝抽离浓硫酸 NaOH溶液或高锰酸钾溶液
【解析】
(1)铜与浓硫酸加热条件下反应生成硫酸铜、二氧化硫、水,依据氧化还原反应写出化学方程式;Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(2)二氧化硫是酸性氧化物溶于水生成亚硫酸显酸性,装置③湿润的pH试纸变红色,证明二氧化硫溶液显酸性;同时证明二氧化硫的漂白性具有选择性,不能漂白变色的pH试纸;
(3)试管②二氧化硫通入后品红褪为无色,加热后无色溶液恢复原来的颜色红色,说明二氧化硫的漂白性不稳定,即二氧化硫和有色物质结合成不稳定的无色物质,加热恢复原来的颜色;
(4)浓硫酸中水的含量很少,开始反应生成的水量少,与铜反应开始生成的硫酸铜不能溶解;实验初期发现大试管内有白色沉淀生成,该物质为CuSO4,故答案为:CuSO4 ;
(5)终止试管①中反应的方法是,停止加热或把铜丝抽离浓硫酸;
(6)装置中 生成的二氧化硫气体是污染性气体,不能排放到空气中,改进装置中的棉花是吸收二氧化硫的作用,可以用氢氧化钠溶液或高锰酸钾溶液等。

 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案