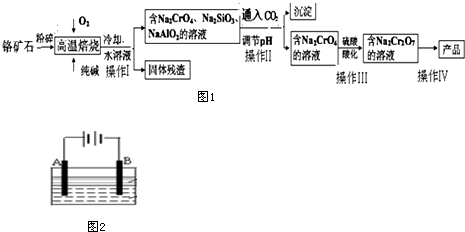
题目内容
15.氮元素可形成卤化物、叠氮化物及络合物等.(1)氢叠氮酸(HN3)是一种弱酸,它的酸性类似于醋酸,微弱电离出H+和N3-.
①与N3-互为等电子体的分子有:N2O或CO2或CS2或BeCl2,由此可推知N3-的立体构型是直线型.
②叠氮化物、氰化物能与Fe3+及Cu2+及Co3+等形成络合物,如:[Co(N3)(NH3)5]SO4、Fe(CN)64-.写出钴原子在基态时的电子排布式:[Ar]3d74s2;[Co(N3)(NH3)5]SO4中钴离子的配位数为6;CN-的电子式是
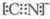 .
.(2)由叠氮化钠(NaN3)热分解可得纯N2:2NaN3(s)=2Na(l)+3N2(g),有关说法正确的是BC (选填序号)
A.NaN3与KN3结构类似,前者晶格能较小
B.第一电离能(I1):N>P>S
C.钠晶胞结构如图1,该晶胞分摊2个钠原子
D.氮气常温下很稳定,是因为氮的电负性大
(3)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图2所示.面心立方晶胞和体心立方晶胞中实际含有的Fe原子个数之比为2:1.

分析 (1)①根据等电子体的定义分析;根据空间构型的判断方法判断;
②根据基态原子的电子排布式书写规则书写;根据配位数的判断方法判断;根据氰阴离子电子式的书写方法进行解答;
(2)A.根据离子半径与晶格能的关系分析;
B.根据最外层电子判断第一电离能的大小;
C.根据晶胞中原子数的计算方法计算;
D.根据氮气的结构分析;
(3)利用均摊法确定晶胞中铁原子个数,从而确定其原子个数之比.
解答 解:(1)①N3-含有三个原子22个电子,与其等电子体的分子有N2O或CO2或CS2或BeCl2,N3-与CO2是等电子体,具有相同的价电子数,它们具有相似的化学结构,二氧化碳是直线型分子,所以N3-的空间构型是直线型.
故答案为:N2O或CO2或CS2或BeCl2; 直线;
②钴是37号元素,其基态原子核外电子排布式为[Ar]3d74s2,[Co(N3)(NH3)5]SO4中其配位数是1+5=6;CN-中碳原子与氮原子之间形成三键,所以CN-电子式为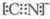 ,
,
故答案为:[Ar]3d74s2;6;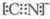 ;
;
(2)A.相同电荷时,晶格能与离子的半径成反比,离子半径越大,晶格能越小,钠离子的离子半径小于钾离子的离子半径,所以NaN3的晶格能大于KN3的晶格能,故A错误.
B.第一电离能(I1):N>P>S,故B正确.
C.钠晶胞中原子数为1+8×$\frac{1}{8}$=2,故C正确.
D.氮气常温下很稳定,是因为分子内氮氮三键,键能较大的原因,故D错误;
故答案为:BC;
(3)体心立方中Fe原子个数=1+8×$\frac{1}{8}$=2、面心立方中Fe原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,所以面心立方晶胞和体心立方晶胞中实际含有的铁原子个数之比=2:4=1:2,
故答案为:1:2.
点评 本题考查了等电子体、配位数、微粒的空间构型、晶格能等知识点,分子的空间构型是每年高考的热点,对此知识点一定掌握;面心立方晶胞和体心立方晶胞,要注意实际含有的原子个数,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. |  分液漏斗 | B. |  蒸发皿 | C. |  坩埚钳 | D. |  滴瓶 |
| A. | 电解质的水溶液一定能导电 | |
| B. | 非电解质的水溶液一定不能导电 | |
| C. | 酸、碱和盐类都属于电解质,其他化合物都是非电解质 | |
| D. | 电解质是在水溶液里或熔融状态下因本身能电离出阳离子和阴离子而导电的化合物 |
| A. | 单位时间生成a mol X,同时生成3 a mol Y | |
| B. | Z的生成速率与Z的分解速率相等 | |
| C. | X、Y、Z的浓度相等 | |
| D. | X、Y、Z的分子个数比为1:3:2 |
| A. | 1mol HCl | B. | 3.01×1023个O2 | C. | 17gNH3 | D. | 11.2LCH4(标况下) |
 如图所示是某化学兴趣小组设计的趣味实验装置图,图中A、D均为碳棒,B铝棒,C为铁棒,所用甲、乙容器中的溶液事前均采取了煮沸处理.B在实验时才插入溶液中.
如图所示是某化学兴趣小组设计的趣味实验装置图,图中A、D均为碳棒,B铝棒,C为铁棒,所用甲、乙容器中的溶液事前均采取了煮沸处理.B在实验时才插入溶液中.