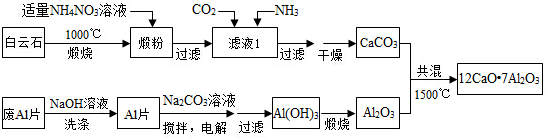
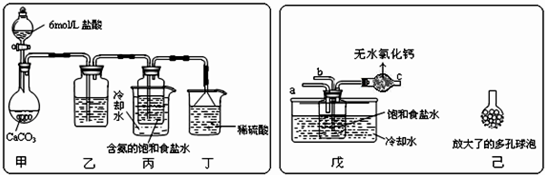
题目内容
1.重铬酸盐广泛用作氧化剂、皮革制作等.以铬矿石(主要成分是Cr2O3,含FeO、Al2O3、SiO2等杂质)为原料制取重铬酸钠的流程如图1: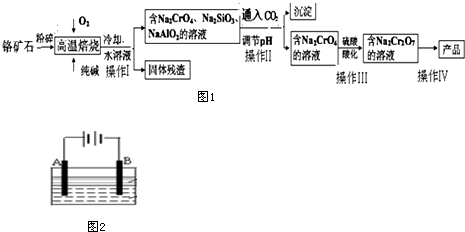
请回答下列问题:
(1)固体残渣主要是含铁元素的氧化物.在高温焙烧时生成Na2CrO4的化学方程式2Cr2O3+4Na2CO3+3O2$\frac{\underline{\;高温\;}}{\;}$4Na2CrO4+4CO2;
(2)操作Ⅱ中通入过量CO2生成沉淀的离子方程式分别为:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
(3)下列仪器在分离出含Na2CrO4溶液的操作中,不需要的是ACE.
A.酒精灯 B.烧杯 C.蒸发皿 D.漏斗 E.冷凝管
(4)用硫酸酸化时发生反应的离子方程式是2CrO42-+2H+=Cr2072-+H20.
(5)工业酸性废水中的Cr2O72-通常以铁做电极,采用电 解法除去.在如图2所示的装置中:
①电极A区Cr2O72-(Cr2O72-还原为Cr3+)发生反应的离子方程式是Cr2072-+6Fe2++14H+=2Cr3++6Fe3++7H20;
②假设一段时间后,所得溶液中Fe3+和Cr3+的物质的量浓度均为0.1 mol/L,要使Fe3+沉淀完全而Cr3+还未开始沉淀.则需调节溶液 pH的范围是3.2~4.3之间.(已知:KSPFe(OH)3=4.0×10-38,KSPCr(OH)3=6.0×10-31,lg$\root{3}{0.4}$=-0.1,lg$\root{3}{4}$=0.2,lg$\root{3}{6}$=0.3,lg$\root{3}{60}$=0.6)
分析 以铬矿石(主要成分是Cr2O3,含FeO、Al2O3、SiO2等杂质)为原料,加入碳酸钠和氧气高温灼烧发生反应生成铬酸钠,二氧化碳,水浸后过滤得到滤渣FeO,滤液为Na2CrO4,Na2SiO3,NaAlO2;调节溶液PH沉淀硅酸跟离子和偏铝酸根离子,过滤得到滤液Na2CrO4,加入硫酸酸化生成重铬酸钠溶液,通过提纯得到重铬酸钠,以此来解答;
(1)水洗后的溶液里含有Na2CrO4,Na2SiO3,NaAlO2,结合质量守恒定律及矿石的成分,可知残渣的成分里含有铁,纯碱和Cr2O3生成Na2CrO4的同时得到CO2气体;
(2)过量的CO2生成的盐是NaHCO3,同时得到弱酸硅酸和氢氧化铝沉淀;
(3)通过过滤分离出含Na2CrO4溶液,只需要漏斗和烧杯及玻璃棒,可判断出不需要的仪器;
(4)硫酸酸化的目的是将Na2CrO4转化为Na2Cr2O7,同时有水生成,据此写出反应方程式,再改写成离子方程式;
(5)①电极A区将Cr2O72-还原为Cr3+,发生的是还原反应,而A极区为阳极,应该发生的是氧化反应,可见铁为阳极,发生氧化反应生成Fe2+,再将Cr2O72-还原为Cr3+,同时得到Fe3+;
②可结合溶度积常数KSPFe(OH)3=4.0×10-38,KSPCr(OH)3=6.0×10-31,计算出Fe3+沉淀完全时溶液的pH及Cr3+开始沉淀时的溶液pH就可以得出pH的范围.
解答 解:以铬矿石(主要成分是Cr2O3,含FeO、Al2O3、SiO2等杂质)为原料,加入碳酸钠和氧气高温灼烧发生反应生成铬酸钠,二氧化碳,水浸后过滤得到滤渣FeO,滤液为Na2CrO4,Na2SiO3,NaAlO2;调节溶液PH沉淀硅酸跟离子和偏铝酸根离子,过滤得到滤液Na2CrO4,加入硫酸酸化生成重铬酸钠溶液,通过提纯得到重铬酸钠;
(1)由上述分析可知,滤渣为FeO,则固体残渣主要是含铁元素的氧化物,在高温焙烧时生成Na2CrO4的化学方程式为2Cr2O3+4Na2CO3+3O2$\frac{\underline{\;高温\;}}{\;}$4Na2CrO4+4CO2,故答案为:铁(或Fe); 2Cr2O3+4Na2CO3+3O2$\frac{\underline{\;高温\;}}{\;}$4Na2CrO4+4CO2;
(2)操作Ⅱ中通入过量CO2生成沉淀的离子方程式分别为SiO32-+2CO2+2H2O=H2SiO3↓+2 HCO3-、AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故答案为:SiO32-+2CO2+2H2O=H2SiO3↓+2HCO3-;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(3)分离出含Na2CrO4溶液,需要过滤,仪器为漏斗、烧杯、玻璃棒,不需要ACE,故答案为:ACE;
(4)用硫酸酸化时发生反应的离子方程式是2CrO42-+2H+=Cr2072-+H20,故答案为:2CrO42-+2H+=Cr2072-+H20;
(5)工业酸性废水中的Cr2O72-通常以铁做电极,则Fe为阳极,失去电子生成亚铁离子,具有还原性,
①电极A区Cr2O72-(Cr2O72-还原为Cr3+)发生反应的离子方程式是Cr2072-+6Fe2++14H+=2Cr3++6Fe3++7H20,故答案为:Cr2072-+6Fe2++14H+=2Cr3++6Fe3++7H20;
②反应后所得溶液中Fe3+和Cr3+的物质的量浓度均为0.1mol/L,要使Fe3+沉 淀完全而Cr3+还未开始沉淀,需要c(Fe3+)=10-5mol/l时铁离子沉淀完全,由溶度积常数Ksp=c(Fe3+)c3(OH-),c3(OH-)=$\frac{4.0×1{0}^{-38}}{1×1{0}^{-5}}$=4.0×10-33 ,c(OH-)=$\root{3}{4.0×1{0}^{-33}}$=$\root{3}{4}$×10-11mol/L,c(H+)=$\frac{1{0}^{-14}}{c(O{H}^{-})}=\frac{1{0}^{-14}}{1{0}^{0.2}×1{0}^{-11}}$=10-3.2,pH=-lgc(H+)=3.2;
Cr3+还未开始沉淀,c(Cr3+)=0.1mol/L,Ksp=c(Cr3+)c3(OH-)=6.0×10-31,c3(OH-)=$\frac{6.0×1{0}^{-31}}{0.1}$=6.0×10-30;c(OH-)=$\root{3}{6}$×10-10mol/L,c(H+)=$\frac{1{0}^{-14}}{1{0}^{0.3}×1{0}^{-10}}$=10-4.3mol/L,pH=-lgc(H+)=4.3,
则要使Fe3+沉淀完全而Cr3+还未开始沉淀.则需调节溶液pH的范围是3.2~4.3,
故答案为:3.2~4.3之间.
点评 本题考查混合物分离提纯的综合应用,为高频考点,把握流程中的反应及混合物分离提纯方法等为解答的关键,侧重分析与应用及计算能力的考查,综合性较强,题目难度中等.

 春雨教育同步作文系列答案
春雨教育同步作文系列答案| A. | 蒸发皿 | B. | 玻璃棒 | C. | 烧杯 | D. | 漏斗 |
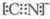 .
.