题目内容
5. 如图所示是某化学兴趣小组设计的趣味实验装置图,图中A、D均为碳棒,B铝棒,C为铁棒,所用甲、乙容器中的溶液事前均采取了煮沸处理.B在实验时才插入溶液中.
如图所示是某化学兴趣小组设计的趣味实验装置图,图中A、D均为碳棒,B铝棒,C为铁棒,所用甲、乙容器中的溶液事前均采取了煮沸处理.B在实验时才插入溶液中.(1)从装置的特点判断,甲、乙装置中甲是原电池,其负极的电极反应式为:Al-3e-+4OH-=AlO2-+2H2O;
(2)实验开始后,(乙)装置中有关电极反应是:C:Fe-2e-=Fe2+
D:2H++2e-=H2↑,D电极上的现象是有无色气体产生,一段时间后溶液中的现象是有白色沉淀生成;
(3)在实验(2)的基础上,改变两装置电极的连接方式,A接D、B接C,此时D极上发生的电极反应式为:4OH--4e-=2H20+O2↑,乙装置里除两电极上有明显的现象外,还可以看到的现象是白色沉淀迅速变为灰绿色,最后变为红褐色,产生该现象的化学反应方程式是4Fe(OH)2+O2+2H2O=4Fe(OH)3.
分析 (1)甲为原电池,乙为电解质,甲中A为正极,B为负极,正极发生还原反应,负极发生氧化反应;
(2)C为阳极,发生氧化反应,D为阴极,发生还原反应;
(3)在实验(2)的基础上,改变两电极的连接方式,A接D、B接C,则D为阳极,C为阴极,阳极生成氧气,阴极生成氢气,氧气可与氢氧化亚铁发生氧化还原反应生成红褐色氢氧化铁.
解答 解:A、D均为碳棒,B为铝棒,C为铁棒,
(1)甲为原电池,乙为电解质,甲中A为正极,B为负极,负极发生还原反应,电极方程式为Al-3e-+4OH-=AlO2-+2H2O,
故答案为:甲;Al-3e-+4OH-=AlO2-+2H2O;
(2)C为阳极,发生氧化反应,电极方程式为Fe-2e-=Fe2+,D为阴极,发生还原反应,电极方程式为2H++2e-=H2↑,则可生成氢氧化亚铁白色沉淀,
故答案为:Fe-2e-=Fe2+;2H++2e-=H2↑;有无色气体产生;有白色沉淀生成;
(3)在实验(2)的基础上,改变两电极的连接方式,A接D、B接C,则D为阳极,C为阴极,阳极生成氧气,电极方程式为4OH--4e-=2H20+O2↑,阴极生成氢气,氧气可与氢氧化亚铁发生氧化还原反应生成红褐色氢氧化铁,可观察到白色沉淀迅速变为灰绿色,最后变为红褐色,产生该现象的化学方程式是4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:4OH--4e-=2H20+O2↑;白色沉淀迅速变为灰绿色,最后变为红褐色;4Fe(OH)2+O2+2H2O=4Fe(OH)3.
点评 本题综合考查原电池和电解池知识,侧重于学生的分析能力和电化学知识的综合运用的考查,为高考常见题型,注意把握电极方程式的书写,难度不大.

练习册系列答案
相关题目
16.对危险化学品要在包装标签上印有警示性标志.下列药品包装图标正确的是( )
| A. |  氢氧化钠 | B. |  红磷 | C. |  硫酸 | D. |  铝合金 |
20.将2.4g Fe、Mg合金投入到一定量的稀硝酸中,金属与硝酸恰好完全反应,共收集到标准状况下的气体VL(硝酸被还原成NO),若向反应后的溶液中加入足量的NaOH溶液,待金属元素全部沉淀后,再将沉淀过滤、洗涤、灼烧后称量,质量为3.6g.则收集到的气体体积V的值不可能为( )
| A. | 1.02 | B. | 1.68 | C. | 1.00 | D. | 0.986 |
10.澄清透明的溶液中能大量共存的是( )
| A. | Cu2+、C1-、SO42-、K+ | B. | K+、OH-、CO32-、Fe2+ | ||
| C. | Ca2+、OH-、C1-、Na+ | D. | Ag+、NO3-、Cl-、K+ |
17.一定温度下,在固定体积的密闭容器中进行下列反应
4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列叙述正确的是( )
4NH3(g)+5O2(g)?4NO(g)+6H2O(g),下列叙述正确的是( )
| A. | 若单位时间内生成xmolNO的同时消耗x molNH3,则反应达到平衡状态 | |
| B. | 当混合气体的压强不再改变,则说明反应已达到平衡状态 | |
| C. | 当混合气体的密度不再改变,则说明反应已达到平衡状态 | |
| D. | 达到化学平衡后,若增大容器容积,正反应速率减小,逆反应速率增大 |
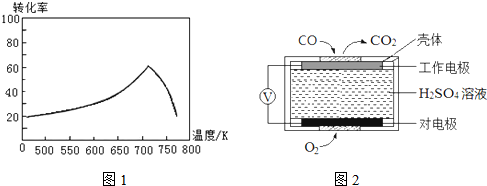
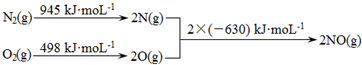
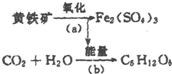 “细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石.例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分为FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如图:
“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石.例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分为FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强,其过程如图: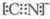 .
.