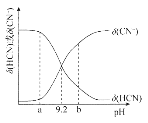
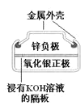
题目内容
【题目】利用下列实验装置进行的相应实验,不能达到实验目的的是

A.用图1所示装置制取氨气
B.用图2所示装置证明非金属性强弱:S>C> Si
C.用图3所示装置证明酸性强弱:硝酸>碳酸>硅酸
D.用图4所示装置制备少量的乙酸乙酯
【答案】C
【解析】
A.生石灰与水反应放热,促使浓氨水中的NH3·H2O分解并挥发,则图中装置能实现氨气的制取,故A不选;
B.比较非金属性,可根据元素对应的最高价氧化物的水化物的酸性强弱比较,根据图示,硫酸与碳酸钠反应生成二氧化碳,二氧化碳气体通入硅酸钠溶液中可得硅酸沉淀,说明酸性:硫酸>碳酸>硅酸,可证明非金属性;S>C> Si,故B不选;
C.浓硝酸与碳酸钠反应生成二氧化碳,但浓硝酸易挥发,生成的二氧化碳气体中混有硝酸气体,硝酸可与硅酸钠溶液反应生成硅酸,不能证明酸性:碳酸>硅酸,故C选;
D.乙醇与乙酸在浓硫酸催化作用下反应生成乙酸乙酯,乙酸乙酯在饱和碳酸钠溶液中的溶解度较小,因此试管中可以盛放饱和碳酸钠溶液,用来除去乙酸乙酯中的杂质,故D不选;
故选C。

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目