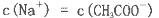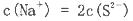题目内容
已知下列弱酸的电离常数:
H2CO3: Ka1=4.30×10-7 ;Ka2=5.61×10-11
H2SO3: Ka1=1.54×10-2;Ka2=1.02×10-7
HClO:Ka=2.95×10-8
下列离子在溶液中结合H+的能力不正确的是
A.HCO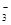 >HSO3- >HSO3- | B.CO >SO >SO | C.HCO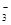 >ClO- >ClO- | D.ClO->SO |
C
解析试题分析:根据弱酸的电离常数判断,酸性越强,其酸根离子结合H+的能力越弱。A、酸性:H2SO3> H2CO3,所以结合H+的能力HCO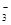 >HSO3-,正确;B、根据H2CO3:Ka2=5.61×10-11 H2SO3: Ka2=1.02×10-7判断酸性:HSO3-> HCO
>HSO3-,正确;B、根据H2CO3:Ka2=5.61×10-11 H2SO3: Ka2=1.02×10-7判断酸性:HSO3-> HCO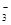 ,所以结合H+的能力CO
,所以结合H+的能力CO >SO
>SO ,正确;C、酸性:H2CO3>HClO,所以结合H+的能力ClO-> HCO
,正确;C、酸性:H2CO3>HClO,所以结合H+的能力ClO-> HCO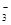 ,错误;D、酸性:HSO3->HClO,所以结合H+的能力ClO->SO
,错误;D、酸性:HSO3->HClO,所以结合H+的能力ClO->SO ,正确,答案选C。
,正确,答案选C。
考点:考查根据电离常数判断酸性的强弱,以及变相的应用酸性的强弱

练习册系列答案
相关题目
下列说法正确的是 ( )
| A.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 |
| B.因为CH3COOH是弱电解质,HCl是强电解质,所以中和等体积等物质的量浓度的醋酸和盐酸时,中和醋酸消耗的NaOH比盐酸消耗的NaOH用量少 |
| C.物质的量浓度相同的磷酸钠溶液和磷酸溶液中PO43-的物质的量浓度相同 |
| D.足量Zn分别和等体积、等物质的量浓度的盐酸和醋酸反应时,产生H2的量相同,放出H2的速率不等 |
已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2;就溶解或电离出S2-的能力而言,FeS>H2S>CuS,则下列离子方程式错误的是
| A.Mg2+ + 2HCO3- + 2Ca2+ + 4OH-= Mg(OH)2↓+ 2CaCO3↓+ 2H2O |
| B.Cu2+ + H2S = CuS↓+ 2H+ |
| C.Zn2+ + S2- + 2H2O = Zn(OH)2↓+ H2S↑ |
| D.FeS + 2H+= Fe2+ + H2S↑ |
25℃时,满足c(CH3COOH)+c(CH3COO-)=0.1mol·L-1的醋酸和醋酸钠混合溶液中,c(CH3COO-)与pH的关系如图所示。下列叙述错误的是
| A.该温度下醋酸的电离常数Ka为l0-4.75mol·L-l |
| B.M点所表示的溶液中: c(Na+)+c(H+)+c(CH3COOH)=0.1 mol·L-1 |
| C.N点所表示的溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
| D.Q点所表示的溶液中加入等体积的0.05mol·L-1NaOH溶液充分反应后pH>7 |
常温下,对于0.1 mol.L-1pH= 10的Na2CO3溶液,下列说法正确的是
| A.通入CO2,溶液pH减小 |
B.加入NaOH固体,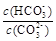 增大 增大 |
| C.由水电离的c(OH-) = 1×10-10 mol.L-1 |
| D.溶液中:c(CO32-)>c(OH-)>c(HCO3-) |
海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。
下列有关说法正确的是
| A.过程①中除去粗盐中的SO、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
| B.用澄清的石灰水可鉴别NaHCO3和Na2CO3 |
| C.过程②中结晶出的MgCl2·6H2O要在HCl氛围中加热脱水制得无水MgCl2 |
| D.工业上通过电解饱和MgCl2溶液制取金属镁 |
溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是( )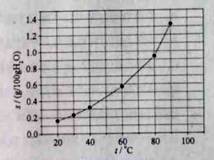
| A.溴酸银的溶解时放热过程 |
| B.温度升高时溴酸银溶解速度加快 |
| C.60 ℃时溴酸银的Ksp约等于6×10-4 |
| D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯 |