题目内容
25℃时,满足c(CH3COOH)+c(CH3COO-)=0.1mol·L-1的醋酸和醋酸钠混合溶液中,c(CH3COO-)与pH的关系如图所示。下列叙述错误的是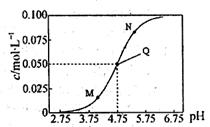
| A.该温度下醋酸的电离常数Ka为l0-4.75mol·L-l |
| B.M点所表示的溶液中: c(Na+)+c(H+)+c(CH3COOH)=0.1 mol·L-1 |
| C.N点所表示的溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
| D.Q点所表示的溶液中加入等体积的0.05mol·L-1NaOH溶液充分反应后pH>7 |
B
解析试题分析:A、根据Q点的pH和CH3COO?可求算电离常数,Ka=c(CH3COO?)?c(H+)/c(CH3COOH)=l0-4.75mol·L-l×0.050mol/L÷0.050mol?L?1= l0-4.75mol·L-l,正确;B、由电荷守恒可得:c(H+)+c(Na+)=C(OH?)+c(CH3COO?),c(CH3COOH)+c(CH3COO-)=0.1mol·L-1,两式联立可得:c(H+)+c(Na+)—C(OH?)+ c(CH3COOH) )=0.1mol·L-1,错误;C、根据图示可知N点c(CH3COO-)>c(CH3COOH),pH<7说明c(H+)>c(OH-),正确;D、Q点所表示的溶液CH3COOH和CH3COONa的浓度均为0.05mol·L-1,加入等体积的0.05mol·L-1NaOH溶液充分反应后,溶质为CH3COONa,水解使溶液呈碱性,正确。
考点:本题考查图像的分析、离子浓度比较。

下列表述中,合理的是
| A.将水加热,Kw增大,pH不变 |
| B.把FeCl3的水溶液加热蒸干可得到FeCl3固体 |
| C.用25 mL碱式滴定管量取20.00mL高锰酸钾溶液 |
| D.用惰性电极电解足量的AgNO3溶液时,当有0.2 mole-转移时会析出21.6g银 |
室温下,对于0.10 mol·L—1的氨水,下列判断正确的是
| A.与AlCl3溶液发生反应的离子方程式为Al3++3OH—=Al(OH)3↓ |
| B.加水稀释后,溶液中c(NH4+)·c(OH—)变大 |
| C.用HNO3溶液完全中和后,溶液不显中性 |
| D.其溶液的pH=13 |
50℃时,下列各溶液中,离子的物质的量浓度关系正确的是
| A.pH=4的醋酸中:c(H+)=4.0molL-1 |
| B.饱和小苏打溶液中:c(Na+)= c(HCO3-) |
| C.饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+c(OH-) |
| D.pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol?L-1 |
已知下列弱酸的电离常数:
H2CO3: Ka1=4.30×10-7 ;Ka2=5.61×10-11
H2SO3: Ka1=1.54×10-2;Ka2=1.02×10-7
HClO:Ka=2.95×10-8
下列离子在溶液中结合H+的能力不正确的是
A.HCO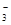 >HSO3- >HSO3- | B.CO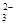 >SO >SO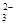 | C.HCO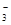 >ClO- >ClO- | D.ClO->SO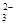 |
下列说法正确的是
| A.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 |
| B.已知AgCl的Ksp=1.8×10-10、Ag2CrO4的Ksp=1.2×10-12,所以相同温度下AgCl的溶解度大于Ag2CrO4 |
| C.常温下,将pH =8的醋酸钠溶液稀释,溶液中所有离子浓度都减小 |
| D.反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)在室温下可自发进行,则该反应的△H<0 |
下列说法中正确的是
| A.0. 1mol/L (NH4)2SO4溶液中:c(SO42—)<c(NH4+) |
| B.相同温度下,0.6 mol/L 氨水溶液与0.3 mol/L 氨水溶液中c(OH—)之比是2:1 |
| C.向0.1 mol/L NaNO3溶液中滴加稀HNO3使溶液中pH=5,则混合溶液中c(Na+)<c(NO3—) |
| D.常温下向CH3COONa溶液中加入适量CH3COOH溶液,使混合液的pH=7,则混合液中c(Na+)<c(CH3COO—) |
已知25℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2)=1.46×10-10。现向1 L 0.2mol·L-1HF溶液中加入1 L 0.2 mol·L-1CaCl2溶液,则下列说法中,正确的是( )
| A.25℃时,0.1 mol·L-1HF溶液中pH=1 | B.Ksp(CaF2)随温度和浓度的变化而变化 |
| C.该体系中有CaF2沉淀产生 | D.加入CaCl2溶液后体系中的c(H+)浓度不变 |
