题目内容
常温下,对于0.1 mol.L-1pH= 10的Na2CO3溶液,下列说法正确的是
| A.通入CO2,溶液pH减小 |
B.加入NaOH固体,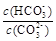 增大 增大 |
| C.由水电离的c(OH-) = 1×10-10 mol.L-1 |
| D.溶液中:c(CO32-)>c(OH-)>c(HCO3-) |
AD
解析试题分析:CO32-+H2O≒HCO3-+OH-,A.当通入二氧化碳后,二氧化碳与水反应生成碳酸,PH值减小,正确;当加入NaOH固体,水解平衡向逆进行,c(HCO3-)减小,c(CO32-)增大,它们的比值减小,错误;C. pH= 10可计算得到c(H+) = 1×10-10 mol.L-1而c(OH-) = 1×10-4 mol.L-1,这个c(OH-)就是水电离出来的,错误;D.溶液中存在CO32-+H2O≒HCO3-+OH-,H2O≒H++OH-,由于水解相对弱,所以此项正确。
考点:盐类水解的影响因素;水的离子积常数;溶液中离子浓度的大小的比较。

练习册系列答案
相关题目
下列说法正确的是
| A.常温下,某溶液中由水电离出的c(H+)=1×10-amo1·L–1,若a<7时,则该溶液可能为NaHSO4溶液 |
| B.常温下,中和同体积、同pH的硫酸、盐酸和醋酸所需相同浓度的NaOH溶液的体积关系:V(硫酸)>V(盐酸)=V(醋酸) |
| C.25℃时,已知Ka(CH3COOH)=1.7×10-5mo1·L–1、Ka(C6H5OH) =1.0×10-10mo1·L–1、 Ka1(H2CO3) = 4.2×10-7mo1·L–1 、Ka2(H2CO3) =5.6×10-11mo1·L–1pH相等的①CH3COONa ②C6H5ONa ③NaHCO3溶液中,c(Na+)大小关系:②<③<① |
| D.常温下,向饱和Na2CO3溶液中加入少量BaSO4粉末,过滤,向洗净的沉淀中加入稀盐酸有气泡产生,说明常温下Ksp(BaSO4)>Ksp(BaCO3) |
将pH=5的H2SO4溶液稀释1000倍后,溶液中SO42-离子浓度与H+离子浓度的比值约为( )
| A.1:10 | B.1:1 | C.1:2 | D.1:20 |
在Na2S溶液中下列关系不正确的是( )
| A.c(Na+)=2c(HS-)+c(S2-)+c(H2S) |
| B.c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) |
| C.c(Na+)> c(S2-)>c(OH-)>c(HS-) |
| D.c(OH-)=c(HS-)+c(H+)+2c(H2S) |
已知下列弱酸的电离常数:
H2CO3: Ka1=4.30×10-7 ;Ka2=5.61×10-11
H2SO3: Ka1=1.54×10-2;Ka2=1.02×10-7
HClO:Ka=2.95×10-8
下列离子在溶液中结合H+的能力不正确的是
A.HCO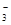 >HSO3- >HSO3- | B.CO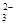 >SO >SO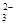 | C.HCO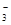 >ClO- >ClO- | D.ClO->SO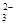 |
下列有关说法正确的是
| A.常温下,0.1 mol·L-1 CH3COOH溶液的pH=1 |
| B.铅蓄电池在放电过程中,负极质量增加,正极pH减少 |
| C.反应CO2(g)+C(s)=2CO(g)在低温下不能自发进行,则其△H>0 |
| D.常温下,向AgCl浊液中加入少量NaCl饱和溶液,则c(Ag+)、Ksp(AgCl)均减小 |
下列说法正确的是( )
| A.在氨水中加入少量的水或氯化铵固体后,都能使溶液中的c(OH-)减小 |
| B.反应Hg(l)+H2SO4(aq)===HgSO4(aq)+H2(g)在常温下不能自发进行,则ΔH<0 |
| C.工业电解食盐水中,电解池被阳离子交换膜隔成阴极室和阳极室,目的是避免阳极产生的气体与烧碱反应 |
| D.在等浓度的NaCl和Na2CrO4稀溶液中滴加AgNO3溶液,先析出AgCl沉淀,则Ksp(AgCl)<Ksp(Ag2CrO4) |
室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是( )
| A.溶液中导电粒子的数目减少 |
B.溶液中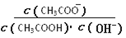 不变 不变 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.再加入10 mL pH=11的NaOH溶液,混合液pH<7 |
下列说法正确的是
| A.NaHCO3溶液加水稀释,c(Na+)/c(HCO3-)的比值保持增大 |
| B.1 mol·L-1的NH4Cl溶液中含有NH4+的数目一定小于NA |
| C.用石墨电极电解FeCl3溶液,阴极反应:2Fe3++6H2O+6e-=2Fe(OH)3↓+3H2↑ |
| D.将带有相反电荷的胶体混合,一定会出现胶体聚沉现象 |