题目内容
【题目】18-Ⅰ分子中只有两种不同化学环境的氢,且数目比为3:2的化合物(________)
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
Ⅱ奥沙拉秦是曾用于治疗急、慢性溃疡性结肠炎的药物,其由水杨酸为起始物的合成路线如下:
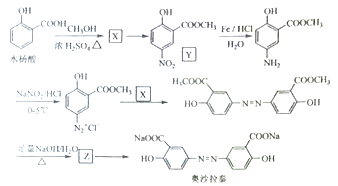
回答下列问题:
(1)X的结构简式为____;由水杨酸制备X的反应类型为_____。
(2)由X制备Y的反应试剂为_________。
(3)工业上常采用廉价的![]() ,与Z反应制备奥沙拉秦,通入的
,与Z反应制备奥沙拉秦,通入的![]() 与Z的物质的量之比至少应为____。
与Z的物质的量之比至少应为____。
(4)奥沙拉秦的分子式为______,其核磁共振氢谱为______组峰,峰面积比为______。
(5)若将奥沙拉秦用![]() 酸化后,分子中含氧官能团的名称为____。
酸化后,分子中含氧官能团的名称为____。
(6)W是水杨酸的同分异构体,可以发生银镜反应;W经碱催化水解后再酸化可以得到对苯二酚。W的结构简式为_______。
【答案】CD 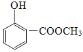 取代反应 浓H2SO4,浓HNO3 2:1 C14H8N2O6Na2 4 1:1:1:1 羧基、羟基
取代反应 浓H2SO4,浓HNO3 2:1 C14H8N2O6Na2 4 1:1:1:1 羧基、羟基 ![]()
【解析】
I.先判断分子中含有的H原子种类,然后确定每种H原子的数目,进而判断H原子的个数比;
II.水杨酸与甲醇在浓硫酸存在条件下发生酯化反应生成的X是水杨酸甲酯,结构简式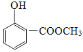 ,X与浓硝酸、浓硫酸混合加热发生硝化反应产生Y,Y与Fe、HCl发生还原反应生成
,X与浓硝酸、浓硫酸混合加热发生硝化反应产生Y,Y与Fe、HCl发生还原反应生成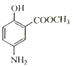 ,
, ![]() 与过量NaOH水溶液加热发生反应生成的Z是
与过量NaOH水溶液加热发生反应生成的Z是![]() ,然后向该溶液中通入足量CO2气体反应生成奥沙拉秦。
,然后向该溶液中通入足量CO2气体反应生成奥沙拉秦。
I.A分子中有两种不同的H原子,个数比为4:4=1:1,A错误;
B.该物质有三种不同的H原子,个数比等于4:4:4=1:1:1,B错误;
C.该物质有两种不同的H原子,个数比等于6:4=3:2,C正确;
D.该物质有两种不同的H原子,个数比等于6:4=3:2,D正确;
故合理选项是CD;
II.根据上述分析可知X是 ,Z是
,Z是![]() 。
。
(1)X的结构简式为 ,由水杨酸与CH3OH在浓硫酸存在和加热条件下发生酯化反应生成
,由水杨酸与CH3OH在浓硫酸存在和加热条件下发生酯化反应生成 和水,酯化反应也属于取代反应;
和水,酯化反应也属于取代反应;
(2)由X与浓硝酸、浓硫酸混合加热,发生取代反应生成Y和水,所以由X制备Y的反应试剂为浓硫酸、浓硝酸。
(3)由于酸性:羧酸>H2CO3>酚>HCO3-,在Z的分子![]() 中含有2个酚钠基团,所以在工业上常采用廉价的CO2与Z反应制备奥沙拉秦,通入的CO2与Z发生反应,为保证Z完全反应,通入的CO2与Z的物质的量之比至少应为2:1。
中含有2个酚钠基团,所以在工业上常采用廉价的CO2与Z反应制备奥沙拉秦,通入的CO2与Z发生反应,为保证Z完全反应,通入的CO2与Z的物质的量之比至少应为2:1。
(4)根据奥沙拉秦的分子结构可知,奥沙拉秦的分子式为C14H8N2O6Na2,在物质分子中含有4种不同位置的H原子,所以其核磁共振氢谱为4组峰,峰面积比为1:1:1:1。
(5)若将奥沙拉秦用![]() 酸化后,得到的物质分子结构为
酸化后,得到的物质分子结构为![]() ,在该分子中含氧官能团的名称为羧基、羟基。
,在该分子中含氧官能团的名称为羧基、羟基。
(6)W是水杨酸的同分异构体,可以发生银镜反应,说明W中含醛基;W经碱催化水解后再酸化可以得到对苯二酚。W的结构简式为![]() 。
。

【题目】由![]() 羟基丁酸生成
羟基丁酸生成![]() 丁内酯的反应如下:HOCH2CH2CH2COOH
丁内酯的反应如下:HOCH2CH2CH2COOH![]() +H2O
+H2O
在298K下,![]() 羟基丁酸水溶液的初始浓度为
羟基丁酸水溶液的初始浓度为![]() ,测得
,测得![]() 丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
| 21 | 50 | 80 | 100 | 120 | 160 | 220 |
|
| 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
(1)该反应在50~80min内的平均反应速率为_____![]() 。
。
(2)120min时![]() 羟基丁酸的转化率为______。
羟基丁酸的转化率为______。
(3)298K时该反应的平衡常数![]() _____。
_____。
(4)为提高![]() 羟基丁酸的平衡转化率,除适当控制反应温度外,还可采取的措施是______。
羟基丁酸的平衡转化率,除适当控制反应温度外,还可采取的措施是______。
【题目】铜阳极泥(主要含有铜、银、金、少量的镍)是有色金属治炼过程中重要的“二次资源”。其合理处理对于实现资源的综合利用具有重要意义。一种从铜阳极泥中分离提取多种金属元素的工艺流程如下

已知:分金液的主要成分为[AuCl4]—;分金渣的主要成分为AgCl;分银液中主要成分为Ag(SO3)2]3—,且存在[Ag(SO3)2]3—![]() Ag++2SO32—
Ag++2SO32—
(1)“分铜”时,单质铜发生反应的化学方程式为_______________________。已知“分铜”时各元素的浸出率如下表所示。
Cu | Au | Ag | Ni | |
浸出率% | 85.7 | 0 | 4.5 | 93.5 |
“分铜”时加入足量的NaC1的主要作用为_________________________________。
(2)“分金”时,单质金发生反应的离子方程式为__________________________。
(3)某小组模拟工业上回收分银渣中的银,过程如下:

中主要反应:AgCl+2SO32—![]() Ag(SO3)23—+C1—
Ag(SO3)23—+C1—
①研究发现:其他条件不变时,该反应在敞口容器中进行,浸出时间过长会使银的浸出率(浸出液中银的质量占起始分银渣中银的质量的百分比)降低,可能原因是____________________。
②将Ⅱ中反应的离子方程式补充完整:
_____Ag(SO3)23-+_____OH—+_____==_____+_____SO32—+_____+CO32—
③中回收液可直接循环使用,但循环多次后,银的浸出率会降低。从回收液离子浓度变化和反应限度的角度分析原因:________________________________________。
(4)工业上,粗银电解精炼时,电解质溶液的pH为1.5~2,电流为5~10A,若用7A的电流电解60min后,得到21.6gAg,则该电解池的电解效率为________%。(保留小数点后位。通过一定电荷量时阴极上实际沉积的金属质量与理论上应沉积的金属质量之比叫电解效率。法拉第常数为96500C·mol—1)

