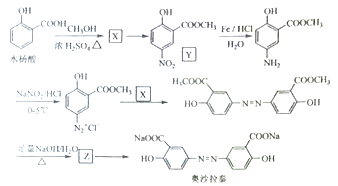
题目内容
【题目】电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a,![]() 、
、![]() 是两块电极板,通过导线与直流电源相连。请回答下列问题:
是两块电极板,通过导线与直流电源相连。请回答下列问题:

(1)若![]() 、
、![]() 都是惰性电极,a是饱和
都是惰性电极,a是饱和![]() 溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则电解池中
溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则电解池中![]() 极现象为______,电极反应式为______,电解
极现象为______,电极反应式为______,电解![]() 溶液的离子方程式是______。
溶液的离子方程式是______。
(2)如要在铁上镀银,电解液选用硝酸银,则![]() 电极的材料是______,电极反应式是______。
电极的材料是______,电极反应式是______。
(3)若![]() 极为铜锌合金,
极为铜锌合金,![]() 极为纯铜,且电解质溶液中含有足量的
极为纯铜,且电解质溶液中含有足量的![]() ,通电一段时间后,若阳极恰好完全溶解,此时阴极质量增加7.68g,溶液质量增加0.03g,则合金中
,通电一段时间后,若阳极恰好完全溶解,此时阴极质量增加7.68g,溶液质量增加0.03g,则合金中![]() 、
、![]() 的物质的量之比为______。
的物质的量之比为______。
【答案】产生气泡,溶液变红 ![]()
![]() 铁
铁 ![]() 3:1
3:1
【解析】
(1)电解饱和![]() 溶液时,由电源可知,X为阴极,Y为阳极,阳极上是氯离子失电子,阴极上是氢离子得电子;
溶液时,由电源可知,X为阴极,Y为阳极,阳极上是氯离子失电子,阴极上是氢离子得电子;
(2)根据电镀银的工作原理知识来回答;
(3)先弄清两个电极的电极反应,再根据得失电子守恒计算。
(1)和电源的负极相连的电极X极是阴极,该电极上氢离子发生得电子的还原反应,即2H++2e-=H2↑,氢离子浓度减小,氢氧根离子浓度增大,酚酞试液变红;和电源的正极相连的电极Y极是阳极,该电极上氯离子发生失电子的氧化反应,即Cl--2e-=Cl2↑,所以电解![]() 溶液的离子方程式是2Cl-+2H2O
溶液的离子方程式是2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑,
2OH-+H2↑+Cl2↑,
故答案为:产生气泡,溶液变红;2H++2e-=H2↑;2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑;
2OH-+H2↑+Cl2↑;
(2)铁上电镀银,电解池的阴极材料是铁,电解液选用硝酸银,Ag+在阴极得电子被还原,电极反应式是Ag++e-=Ag,
故答案为:铁;Ag++e-=Ag;
(3)从装置中看Y电极是阳极,X电极是阴极,锌比铜活泼,优先铜放电,然后铜再放电。反应过程阳极:Zn-2e-=Zn2+,Cu-2e-=Cu2+, 阴极:Cu2++2e-=Cu
第一个阶段,溶液质量增加,第二阶段溶液质量不变;
设合金中铜锌的物质的量分别是x、y,所以由电子转移守恒可得:
65g/moly-64g/moly=0.03g
64g/mol(x+y)=7.68g,x=0.09mol,y=0.03mol,所以可得 ![]() = 3︰1 。
= 3︰1 。
故答案为:3:1。

 阅读快车系列答案
阅读快车系列答案