题目内容
【题目】氟代硼酸钾(KBe2BO3F2)是激光器的核心材料,我国化学家在此领域的研究走在了世界的最前列。回答下列问题:
(1)氟代硼酸钾中非金属元素原子的电负性大小顺序是__。基态K+的电子排布式为__。
(2)NaBH4是有机合成中常用的还原剂,其中的阴离子空间构型是__,中心原子的杂化方式为__。NaBH4中存在__(填标号)。
a.离子键 b.氢键 c.σ键 d.π键
(3)BeCl2中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在的BeCl2的结构式为__,其中Be的配位数为__。
(4)第三周期元素氟化物的熔点如下表:
化合物 | NaF | MgF2 | AlF3 | SiF4 | PF5 | SF6 |
熔点/℃ | 993 | 1261 | 1291 | -90 | -83 | -50.5 |
解释表中氟化物熔点变化的原因:___。
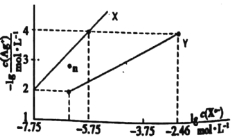
(5)CaF2的一种晶胞如图所示。Ca2+占据F-形成的空隙,若r(F-)=xpm,r(Ca2+)=ypm,设阿伏加德罗常数的值为NA,则CaF2的密度ρ=__g·cm-3(列出计算表达式)。

【答案】F>O>B 1s22s22p63s23p6或[Ar] 正四面体 sp3 ac ![]() 3 前三种为离子晶体,晶格能依次增大,后三种为分子晶体,分子间力依次增大
3 前三种为离子晶体,晶格能依次增大,后三种为分子晶体,分子间力依次增大 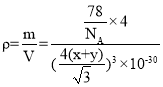
【解析】
(1)氟代硼酸钾中非金属元素有F、O、B,元素的非金属性越强,电负性越大;基态K+核外电子总数为18;
(2)BH4-的中心原子B原子孤电子对数=![]() =0,价层电子对数=0+4=0,微粒空间构型与VSEPR模型相同;Na+与BH4-之间形成离子键,B原子有3个价电子,H有空轨道,而BH4-中形成4个B-H键,故BH4-中含有1个配位键、3个σ键;
=0,价层电子对数=0+4=0,微粒空间构型与VSEPR模型相同;Na+与BH4-之间形成离子键,B原子有3个价电子,H有空轨道,而BH4-中形成4个B-H键,故BH4-中含有1个配位键、3个σ键;
(3)双聚分子为Be2Cl4,Be原子价电子数为2,形成2个Be-Cl键,Be原子有空轨道、Cl原子有孤电子对,每个BeCl2分子中的1个Cl原子另外分子中Be原子之间形成1个配位键;
(4)氟化物的熔点与晶体类型,离子晶体的熔点较高,分子晶体的熔点较低;离子半径越小、电荷越大,晶格能越大,离子晶体的熔沸点越高。而相对分子质量越大,分子间作用力越强,分子晶体的熔沸点越高;
(5)晶胞中白色球数目为4、黑色球数目为1+8×![]() +6×
+6×![]() +12×
+12×![]() =8,结合化学式可知,白色球代表Ca2+、黑色球代表F-,Ca2+占据F-形成的立方体的体心,晶胞中F-形成8个小立方体,只有4个Ca2+占据;处于晶胞中F-形成的小立方体体心的Ca2+与小立方体顶点F-紧密相邻,若r(F-)=xpm,r(Ca2+)=ypm,则小立方体棱长=
=8,结合化学式可知,白色球代表Ca2+、黑色球代表F-,Ca2+占据F-形成的立方体的体心,晶胞中F-形成8个小立方体,只有4个Ca2+占据;处于晶胞中F-形成的小立方体体心的Ca2+与小立方体顶点F-紧密相邻,若r(F-)=xpm,r(Ca2+)=ypm,则小立方体棱长=![]() pm,故晶胞棱长=
pm,故晶胞棱长=![]() pm,计算晶胞中微粒总质量,即为晶胞质量,晶体密度=晶胞质量÷晶胞体积。
pm,计算晶胞中微粒总质量,即为晶胞质量,晶体密度=晶胞质量÷晶胞体积。
(1)氟代硼酸钾中非金属元素有F、O、B,非金属性强弱顺序为F>O>B,电负性大小顺序为F>O>B;基态K+核外电子总数为18,则电子排布式为1s22s22p63s23p6或[Ar];
(2)BH4-的中心原子B原子孤电子对数=![]() =0,价层电子对数=0+4=0,微粒空间构型与VSEPR模型相同为正四面体形,B原子采取sp3杂化;Na+与BH4-之间形成离子键,B原子有3个价电子,H有空轨道,而BH4-中形成4个B-H键,故BH4-中含有1个配位键、3个σ键,没有氢键与π键,故答案为ac;
=0,价层电子对数=0+4=0,微粒空间构型与VSEPR模型相同为正四面体形,B原子采取sp3杂化;Na+与BH4-之间形成离子键,B原子有3个价电子,H有空轨道,而BH4-中形成4个B-H键,故BH4-中含有1个配位键、3个σ键,没有氢键与π键,故答案为ac;
(3)双聚分子为Be2Cl4,Be原子价电子数为2,形成2个Be-Cl键,Be原子有空轨道、Cl原子有孤电子对,每个BeCl2分子中的1个Cl原子另外分子中Be原子之间形成1个配位键,BeCl2的结构式为![]() ,其中Be的配位数为3;
,其中Be的配位数为3;
(4)NaF、MgF2和AlF3为离子晶体,晶格能依次增大,熔点依次升高,而SiF4、
(5)晶胞中白色球数目为4、黑色球数目为1+8×![]() +6×
+6×![]() +12×
+12×![]() =8,结合化学式可知,白色球代表Ca2+、黑色球代表F-,Ca2+占据F-形成的立方体的体心,晶胞中F-形成8个小立方体,只有4个Ca2+占据,可知Ca2+占据F-形成的空隙占有率为50%;处于晶胞中F-形成的小立方体体心的Ca2+与小立方体顶点F-紧密相邻,若r(F-)=xpm,r(Ca2+)=ypm,则小立方体棱长=
=8,结合化学式可知,白色球代表Ca2+、黑色球代表F-,Ca2+占据F-形成的立方体的体心,晶胞中F-形成8个小立方体,只有4个Ca2+占据,可知Ca2+占据F-形成的空隙占有率为50%;处于晶胞中F-形成的小立方体体心的Ca2+与小立方体顶点F-紧密相邻,若r(F-)=xpm,r(Ca2+)=ypm,则小立方体棱长=![]() pm,故晶胞棱长=
pm,故晶胞棱长=![]() pm,晶胞相当于含有4个“CaF2”,晶胞质量=4×
pm,晶胞相当于含有4个“CaF2”,晶胞质量=4×![]() g,晶体密度
g,晶体密度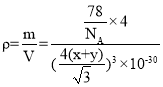 gcm-3。
gcm-3。

 阅读快车系列答案
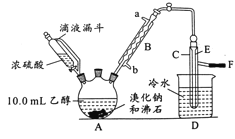
阅读快车系列答案【题目】实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理为H2SO4(浓)+NaBr![]() NaHSO4+HBr↑、CH3CH2OH+HBr
NaHSO4+HBr↑、CH3CH2OH+HBr![]() CH3CH2Br+H2O。有关数据和实验装置如(反应需要加热,图中省去了加热装置):
CH3CH2Br+H2O。有关数据和实验装置如(反应需要加热,图中省去了加热装置):
乙醇 | 溴乙烷 | 溴 | |
状态 | 无色 液体 | 无色 液体 | 深红棕色 液体 |
密度/g·cm-3 | 0.79 | 1.44 | 3.1 |
沸点/℃ | 78.5 | 38.4 | 59 |
(1)A中放入沸石的作用是__,B中进水口为__口(填“a”或“b”)。
(2)实验中用滴液漏斗代替分液漏斗的优点为__。
(3)氢溴酸与浓硫酸混合加热发生氧化还原反应的化学方程式__。
(4)给A加热的目的是__,F接橡皮管导入稀NaOH溶液,其目的是吸收__和溴蒸气,防止__。
(5)C中的导管E的末端须在水面以下,其原因是__。
(6)将C中的镏出液转入锥形并瓶中,连振荡边逐滴滴入浓H2SO41~2mL以除去水、乙醇等杂质,使溶液分层后用分液漏斗分去硫酸层;将经硫酸处理后的溴乙烷转入蒸镏烧瓶,水浴加热蒸馏,收集到35~40℃的馏分约10.0g。
①分液漏斗在使用前必须__;
②从乙醇的角度考虑,本实验所得溴乙烷的产率是__(精确到0.1%)。