题目内容
【题目】研究水体中碘的存在形态及其转化是近年的科研热点。![]() 与
与![]() 在水体和大气中的部分转化如下图所示。
在水体和大气中的部分转化如下图所示。

(1)碘在元素周期表的位置:______________________,其中一种人工放射性核素131I常用于甲亢的治疗,该核素含有的中子数为___________。
(2)结合元素周期律分析Cl-、I-的还原性强弱:同主族元素的原子,从上到下,____________。
(3)水体中的I-的非酸性条件下不易被空气中的![]() 氧化。原因是
氧化。原因是![]() 的反应速率慢,反应程度小。碘化铵是一种重要的含I-的盐,常用于医药和照相工业,该电子式为________________,其水溶液却易被空气中的
的反应速率慢,反应程度小。碘化铵是一种重要的含I-的盐,常用于医药和照相工业,该电子式为________________,其水溶液却易被空气中的![]() 氧化的原因是_____________________。
氧化的原因是_____________________。
(4)大气中的部分碘源于![]() 对海水中I-的氧化,有资料显示:水体中若含有
对海水中I-的氧化,有资料显示:水体中若含有![]() ,会对
,会对![]() 氧化I-产生促进作用。为检验这一结论,进行如下探究实验:分别将等量的
氧化I-产生促进作用。为检验这一结论,进行如下探究实验:分别将等量的![]() 通入到20mL下列试剂中,一段时间后,记录实验现象与结果。
通入到20mL下列试剂中,一段时间后,记录实验现象与结果。
已知:每![]() 参与反应,生成
参与反应,生成![]() 。
。
序号 | 试剂 组成 | 反应前溶液 的 | 反应后溶液 的 |
转化率 |
的生成量 |
A |
|
|
| 约 | —— |
B |
|
|
| —— | 少量 |
C |
|
|
| 约 | 大量 |
① a=__________。
② 用离子方程式解释A中pH增大的原因_______________________________________。
③ 写出B中产生![]() 的离子方程式_________________________________________。
的离子方程式_________________________________________。
④ C中实验进行20s后,发现溶液中![]() 浓度开始下降。导致下降的直接原因有_______。
浓度开始下降。导致下降的直接原因有_______。
A ![]() 减小 B
减小 B ![]() 减小 C
减小 C ![]() 不断生成
不断生成
【答案】第5周期第VIIA族 78 原子半径逐渐增大,得电子能力逐渐减弱,非金属性Cl>I,单质氧化性Cl2>I2,因此离子的还原性Cl-<I- 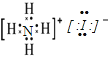 NH4+水解显酸性,中和OH-,使平衡2H2O+4I-+O2
NH4+水解显酸性,中和OH-,使平衡2H2O+4I-+O2![]() 2I2+4OH-正向移动 3
2I2+4OH-正向移动 3![]() 10-2 H2O+2I-+O3
10-2 H2O+2I-+O3![]() I2+2OH-+O2 2Fe2++O3+5H2O=2Fe(OH)3+4H++O2 B
I2+2OH-+O2 2Fe2++O3+5H2O=2Fe(OH)3+4H++O2 B
【解析】
(1)碘是53号元素;中子数=质量数-质子数;
(2)同主族元素的原子,从上到下,原子半径逐渐增大,得电子能力逐渐减弱;
(3)碘化铵为离子化合物,含有NH4+和I-;NH4+水解显酸性,中和OH-,使平衡2H2O+4I-+O2![]() 2I2+4OH-正向移动;
2I2+4OH-正向移动;
(4)①根据对照试验,控制变量来分析解答;
② A中发生的反应为H2O+2I-+O3![]() I2+2OH-+O2,生成了OH-,溶液的碱性增强,pH增大;
I2+2OH-+O2,生成了OH-,溶液的碱性增强,pH增大;
③B中反应后生成了Fe(OH)3,溶液的pH减小,说明有H+生成,根据电子守恒和电荷守恒写出离子方程式;
④根据浓度对平衡移动的影响分析解答。
(1)碘是53号元素,碘原子核外有5个电子层,最外层电子数为7,所以碘在元素周期表中位于:第5周期第VIIA族;131I中的质量数为131,质子数为53,则中子数=质量数-质子数=131-53=78。
故答案为:第5周期第VIIA族;78;
(2)同主族元素的原子,从上到下,原子半径逐渐增大,得电子能力逐渐减弱,非金属性Cl>I,单质氧化性Cl2>I2,因此离子的还原性Cl-<I-。
故答案为:原子半径逐渐增大,的电子能力逐渐减弱,非金属性Cl>I,单质氧化性Cl2>I2,因此离子的还原性Cl-<I-;
(3)碘化铵为离子化合物,含有NH4+和I-,故电子式为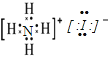 ;
;
NH4+水解显酸性,中和OH-,使平衡2H2O+4I-+O2![]() 2I2+4OH-正向移动,所以其水溶液易被空气中的O2氧化。
2I2+4OH-正向移动,所以其水溶液易被空气中的O2氧化。
故答案为:NH4+水解显酸性,中和OH-,使平衡2H2O+4I-+O2![]() 2I2+4OH-正向移动;
2I2+4OH-正向移动;
(4)①该实验为探究水体中若含有![]() ,会对O3氧化I-产生促进作用,应在其它条件相同的条件下实验,对比A、B、C3组实验,若要使Cl-浓度相同,则a的值为3
,会对O3氧化I-产生促进作用,应在其它条件相同的条件下实验,对比A、B、C3组实验,若要使Cl-浓度相同,则a的值为3![]() 10-2。
10-2。
故答案为:3![]() 10-2;
10-2;
② A中发生的反应为H2O+2I-![]() I2+2OH-+O2,生成了OH-,溶液的碱性增强,pH增大。
I2+2OH-+O2,生成了OH-,溶液的碱性增强,pH增大。
故答案为:H2O+2I-+O3![]() I2+2OH-+O2;
I2+2OH-+O2;
③B中反应后生成了Fe(OH)3,溶液的pH减小,说明有H+生成,根据电子守恒和电荷守恒写出离子方程式为:2Fe2++O3+5H2O=2Fe(OH)3+4H++O2。
故答案为:2Fe2++O3+5H2O=2Fe(OH)3+4H++O2;
④对比表格中第A、C组实验前后pH可得,A组pH增大,c(H+)减小,C组pH减小,c(H+)增大,C中实验进行20s后,发现溶液中![]() 浓度开始下降,根据上述分析可得,若c(H+)减小,I3-浓度不会下降,故A项不选;
浓度开始下降,根据上述分析可得,若c(H+)减小,I3-浓度不会下降,故A项不选;
若c(I-)减小,导致I2(aq)+I-(aq)![]() I3-(aq)的平衡左移,所以I3-浓度下降,所以c(I-)减小是导致I3-浓度下降的直接原因,故选B项;
I3-(aq)的平衡左移,所以I3-浓度下降,所以c(I-)减小是导致I3-浓度下降的直接原因,故选B项;
若I2(g)不断生成,导致I2(aq)![]() I2(g)的溶解平衡右移,使溶液中c(I2)减小,导致 I2(aq)+I-(aq)
I2(g)的溶解平衡右移,使溶液中c(I2)减小,导致 I2(aq)+I-(aq)![]() I3-(aq)的平衡左移,则I3-浓度下降,但不是导致I3-浓度下降的直接原因,故不选C项。
I3-(aq)的平衡左移,则I3-浓度下降,但不是导致I3-浓度下降的直接原因,故不选C项。
故选B。

【题目】“铝热反应”的化学方程式为2Al+Fe2O3![]() Al2O3+2Fe。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
Al2O3+2Fe。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
沸点/℃ | 2 467 | 2 980 | 2 750 | —— |
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金。这种推测有一定的道理,理由是________________________________________________________________________。
(2)根据已有知识找出一种验证产物中有Fe的最简单方法:_____________________。
(3)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是________,当观察到________时,说明熔融物中含有金属铝。
(4)实验室溶解该熔融物,最好选用下列试剂中的____(填字母),理由是__________。
A.浓硫酸 B.稀硫酸
C.稀硝酸 D.氢氧化钠溶液