题目内容
【题目】纳米TiO2是一种重要的光催化剂。以钛酸酯Ti(OR)4为原料制备纳米TiO2的步骤如下:
①组装装置如下图所示,保持温度约为65℃,先将30mL钛酸四丁酯[Ti(OC4H9)4]加入盛有无水乙醇的三颈烧瓶,再加入3mL乙酰丙酮,充分搅拌;
②将含水20%的乙醇溶液缓慢滴入三颈烧瓶中,得到二氧化钛溶胶;
③将二氧化钛溶胶干燥得到二氧化钛凝胶,灼烧凝胶得到纳米TiO2。
已知,钛酸四丁酯能溶于除酮类物质以外的大部分有机溶剂,遇水剧烈水解;Ti(OH)4不稳定,易脱水生成TiO2,回答下列问题:
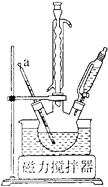
(1)仪器a的名称是_______,冷凝管的作用是________。
(2)加入的乙酰丙酮可以减慢水解反应的速率,其原理可能是________(填标号)。
a.增加反应的焓变 b.增大反应的活化能
c.减小反应的焓变 d.降低反应的活化能
制备过程中,减慢水解反应速率的措施还有________。
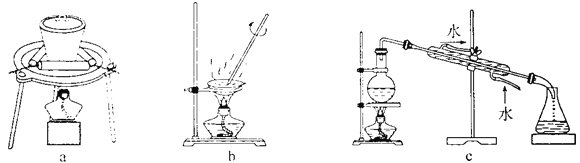
(3)步骤②中制备二氧化钛溶胶的化学方程式为________。下图所示实验装置中,可用于灼烧二氧化钛凝胶的是________(填标号)。
(4)测定样品中TiO2纯度的方法是:精确称取0.2000 g样品放入锥形瓶中,加入硫酸和硫酸铵的混合溶液,加强热使其溶解。冷却后,加入一定量稀盐酸得到含TiO2+的溶液。加入金属铝,将TiO2+全部转化为Ti3+。待过量的金属铝完全溶解并冷却后,加入指示剂,用0.1000 mol·L-lNH4Fe(SO4)2溶液滴定至终点。重复操作2次,消耗0.1000 mol·L-1 NH4Fe(SO4)2溶液的平均值为20.00 mL(已知:Ti3+ +Fe3++H2O=TiO2+ +Fe2+ +2H+)。
①加入金属铝的作用除了还原TiO2+外,另一个作用是________________。
②滴定时所用的指示剂为____________(填标号)
a.酚酞溶液 b. KSCN溶液 c. KMnO4溶液 d.淀粉溶液
③样品中TiO2的质量分数为________%。
【答案】温度计 冷凝回流 b 用含水20%的乙醇溶液代替水、缓慢滴液 Ti(OC4H9)4+2H2O= TiO2+4 C4H9OH a 与酸反应生成氢气,形成氢气氛围,防止Ti3+在空气中被氧化 b 80
【解析】
(1)根据水、无水乙醇和乙酰丙酮容易挥发分析解答;
(2)反应的焓变只与初始状态和终了状态有关;增大反应的活化能,反应速率减慢;降低反应的活化能,反应速率加快,据此分析判断;根据实验步骤②的提示分析判断;
(3) Ti(OH)4不稳定,易脱水生成TiO2,钛酸四丁酯[Ti(OC4H9)4]水解生成二氧化钛溶胶,据此书写反应的化学方程式;灼烧固体需要在坩埚中进行;
(4)根据Ti3+ +Fe3++H2O=TiO2+ +Fe2+ +2H+,说明Ti3+容易被氧化;并据此分析判断可以选用的指示剂,结合消耗的NH4Fe(SO4)2的物质的量计算样品中TiO2的质量分数。
(1)根据装置图,仪器a为温度计,实验过程中为了防止水、无水乙醇和乙酰丙酮挥发,可以使用冷凝管冷凝回流,提高原料的利用率,故答案为:温度计;冷凝回流;
(2) a.反应的焓变只与初始状态和终了状态有关,加入的乙酰丙酮,改变是反应的条件,不能改变反应的焓变,故a错误;b. 增大反应的活化能,活化分子数减少,反应速率减慢,故b正确;c. 反应的焓变只与初始状态和终了状态有关,加入的乙酰丙酮,改变是反应的条件,不能改变反应的焓变,故c错误;d.降低反应的活化能,活化分子数增多,反应速率加快,故d错误;故选b;根据实验步骤②的提示,制备过程中,用含水20%的乙醇溶液代替水、缓慢滴液,减慢钛酸四丁酯[Ti(OC4H9)4]水解的反应速率,故答案为:b;用含水20%的乙醇溶液代替水、缓慢滴液;
(3) Ti(OH)4不稳定,易脱水生成TiO2,步骤②中钛酸四丁酯[Ti(OC4H9)4]水解生成二氧化钛溶胶,反应的化学方程式为Ti(OC4H9)4+2H2O= TiO2+4 C4H9OH;灼烧二氧化钛凝胶需要在坩埚中进行,故选择的装置为a,故答案为:Ti(OC4H9)4+2H2O= TiO2+4 C4H9OH;a;
(4)①根据Ti3+ +Fe3++H2O=TiO2+ +Fe2+ +2H+,说明Ti3+容易被氧化,铝与酸反应生成氢气,在液面上方形成氢气氛围,防止Ti3+在空气中被氧化,故答案为:与酸反应生成氢气,形成氢气氛围,防止Ti3+在空气中被氧化;
②酚酞溶液、淀粉溶液与NH4Fe(SO4)2溶液,现象不明显;KMnO4溶液也能氧化Ti3+,影响滴定结果,KMnO4不与Fe3+反应;根据滴定反应Ti3+ +Fe3++H2O=TiO2+ +Fe2+ +2H+可知,可以选用KSCN溶液作指示剂,当滴入最后一滴NH4Fe(SO4)2溶液,容易变成血红色,且半分钟不褪色,说明到达了滴定终点,故答案为:b;
③消耗的NH4Fe(SO4)2的物质的量=0.02L×0.1000 mol·L-1=0.002mol,则根据钛原子守恒,n(TiO2)=n(Ti3+)=n(Fe3+)=0.002mol,样品中TiO2的质量分数=![]() ×100%=80%,故答案为:80。
×100%=80%,故答案为:80。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】研究水体中碘的存在形态及其转化是近年的科研热点。![]() 与
与![]() 在水体和大气中的部分转化如下图所示。
在水体和大气中的部分转化如下图所示。

(1)碘在元素周期表的位置:______________________,其中一种人工放射性核素131I常用于甲亢的治疗,该核素含有的中子数为___________。
(2)结合元素周期律分析Cl-、I-的还原性强弱:同主族元素的原子,从上到下,____________。
(3)水体中的I-的非酸性条件下不易被空气中的![]() 氧化。原因是
氧化。原因是![]() 的反应速率慢,反应程度小。碘化铵是一种重要的含I-的盐,常用于医药和照相工业,该电子式为________________,其水溶液却易被空气中的
的反应速率慢,反应程度小。碘化铵是一种重要的含I-的盐,常用于医药和照相工业,该电子式为________________,其水溶液却易被空气中的![]() 氧化的原因是_____________________。
氧化的原因是_____________________。
(4)大气中的部分碘源于![]() 对海水中I-的氧化,有资料显示:水体中若含有
对海水中I-的氧化,有资料显示:水体中若含有![]() ,会对
,会对![]() 氧化I-产生促进作用。为检验这一结论,进行如下探究实验:分别将等量的
氧化I-产生促进作用。为检验这一结论,进行如下探究实验:分别将等量的![]() 通入到20mL下列试剂中,一段时间后,记录实验现象与结果。
通入到20mL下列试剂中,一段时间后,记录实验现象与结果。
已知:每![]() 参与反应,生成
参与反应,生成![]() 。
。
序号 | 试剂 组成 | 反应前溶液 的 | 反应后溶液 的 |
转化率 |
的生成量 |
A |
|
|
| 约 | —— |
B |
|
|
| —— | 少量 |
C |
|
|
| 约 | 大量 |
① a=__________。
② 用离子方程式解释A中pH增大的原因_______________________________________。
③ 写出B中产生![]() 的离子方程式_________________________________________。
的离子方程式_________________________________________。
④ C中实验进行20s后,发现溶液中![]() 浓度开始下降。导致下降的直接原因有_______。
浓度开始下降。导致下降的直接原因有_______。
A ![]() 减小 B
减小 B ![]() 减小 C
减小 C ![]() 不断生成
不断生成




