题目内容
【题目】将1 mol X、3 mol Y充入一个密闭容器中,在一定条件下发生如下反应并达到平衡:X(g) +3Y(g) ![]() 2Z(g);ΔH<0。当改变某个条件并达到新平衡后,下列叙述正确的是 ( )
2Z(g);ΔH<0。当改变某个条件并达到新平衡后,下列叙述正确的是 ( )
A.升高温度,X的体积分数减小
B.缩小体积,Y的物质的量浓度不变
C.保持容器体积不变,充入1mol的稀有气体He,Z的浓度不变
D.保持容器体积不变,充入2mol的Z(g),X的体积分数增大
【答案】C
【解析】
试题分析:A、该反应为放热反应,升高温度,平衡逆向移动,X的体积分数增大,错误;B、缩小体积,Y的物质的量浓度增大,错误;C、保持容器体积不变,充入1mol的稀有气体He,Z的物质的量不变,浓度不变,正确;D、保持容器体积不变,充入2mol的Z(g),相当于增大压强,平衡正向移动,X的体积分数减小,错误。

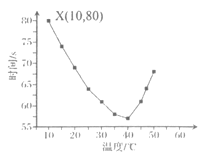
【题目】一定温度下,体积为2 L的密闭容器中X、Y、Z三种气体的初始物质的量和平衡物质的量如下表:
物质 | X | Y | Z |
初始物质的量(mol) | 0.2 | 0.2 | 0 |
平衡物质的量(mol) | 0.1 | 0.05 | 0.1 |
下列说法正确的是( )
A. 反应可表示为2X+3Y![]() 2Z,其平衡常数为8 000
2Z,其平衡常数为8 000
B. 增大压强使平衡向生成Z的方向移动,平衡常数增大
C. 若将容器的体积压缩至1 L,则X的体积分数减小,浓度增大
D. 若升高温度时,Z的浓度增大,可知温度升高时正反应速率增大,逆反应速率 减小,平衡向正反应方向移动
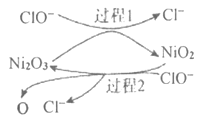
【题目】研究水体中碘的存在形态及其转化是近年的科研热点。![]() 与
与![]() 在水体和大气中的部分转化如下图所示。
在水体和大气中的部分转化如下图所示。

(1)碘在元素周期表的位置:______________________,其中一种人工放射性核素131I常用于甲亢的治疗,该核素含有的中子数为___________。
(2)结合元素周期律分析Cl-、I-的还原性强弱:同主族元素的原子,从上到下,____________。
(3)水体中的I-的非酸性条件下不易被空气中的![]() 氧化。原因是
氧化。原因是![]() 的反应速率慢,反应程度小。碘化铵是一种重要的含I-的盐,常用于医药和照相工业,该电子式为________________,其水溶液却易被空气中的
的反应速率慢,反应程度小。碘化铵是一种重要的含I-的盐,常用于医药和照相工业,该电子式为________________,其水溶液却易被空气中的![]() 氧化的原因是_____________________。
氧化的原因是_____________________。
(4)大气中的部分碘源于![]() 对海水中I-的氧化,有资料显示:水体中若含有
对海水中I-的氧化,有资料显示:水体中若含有![]() ,会对
,会对![]() 氧化I-产生促进作用。为检验这一结论,进行如下探究实验:分别将等量的
氧化I-产生促进作用。为检验这一结论,进行如下探究实验:分别将等量的![]() 通入到20mL下列试剂中,一段时间后,记录实验现象与结果。
通入到20mL下列试剂中,一段时间后,记录实验现象与结果。
已知:每![]() 参与反应,生成
参与反应,生成![]() 。
。
序号 | 试剂 组成 | 反应前溶液 的 | 反应后溶液 的 |
转化率 |
的生成量 |
A |
|
|
| 约 | —— |
B |
|
|
| —— | 少量 |
C |
|
|
| 约 | 大量 |
① a=__________。
② 用离子方程式解释A中pH增大的原因_______________________________________。
③ 写出B中产生![]() 的离子方程式_________________________________________。
的离子方程式_________________________________________。
④ C中实验进行20s后,发现溶液中![]() 浓度开始下降。导致下降的直接原因有_______。
浓度开始下降。导致下降的直接原因有_______。
A ![]() 减小 B
减小 B ![]() 减小 C
减小 C ![]() 不断生成
不断生成