题目内容
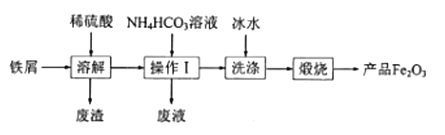
【题目】我国拥有丰富的稀土矿产资源,在合金中加入适量的稀土金属,能大大改善合金的性能,因而,稀土金属又被称为冶金工业的维生素。铈是一种重要的稀土元素,常见的化合价为+3和+4。某课题小组以平板电视显示屏生产过程中,产生的大量废玻璃粉末为原料(其中含有SiO2、Fe2O3、CeO2、FeO等物质),制取CeO2和硫酸铁铵矾[NH4Fe(SO4)212H2O],流程如下:
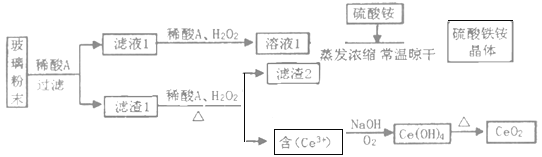
已知:CeO2不溶于强酸或强碱
(1)稀酸A中酸的分子式是___。滤渣2的主要成分___。(填化学式)
(2)滤液1中加入H2O2溶液的目的是___。滤渣1中加入H2O2,主要利用了H2O2的什么性质?___。
(3)酸性条件下,H2O2、Fe3+、CeO2三种物质,氧化性由强到弱的顺序是___。
(4)写出由滤液2生成Ce(OH)4的离子方程式___。
(5)硫酸铁铵矾[NH4Fe(SO4)212H2O]广泛用于水的净化处理,其净水原理是___(用离子方程式表示)。
(6)取上述流程中所获得的Ce(OH)4样品5.31g,加稀H2SO4溶解后配制成100mL溶液,取出10.00mL,用浓度为0.1000 molL-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗25.00mL标准溶液。该样品中Ce(OH)4的纯度是___。
【答案】H2SO4 SiO2 Fe2+氧化为Fe3+ 还原性 CeO2> H2O2> Fe3+ 4Ce3++O2+12OH-+2H2O═4Ce(OH)4↓ Fe3++3H2OFe(OH)3(胶体)+3H+ ![]() %
%
【解析】
反应过程为:废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)中加入稀硫酸,FeO转化为FeSO4、Fe2O3转化Fe2(SO4)3存在于滤液1中,滤渣1为CeO2和SiO2;滤液1中加入稀硫酸和过氧化氢,被FeSO4氧化为Fe2(SO4)3,溶液1为Fe2(SO4)3溶液,加入硫酸铵混合蒸发浓缩、常温晾干后得到硫酸铁铵晶体;滤渣1中加入稀硫酸和H2O2,CeO2转化为Ce3+存在于滤液2中,反应为2CeO2+H2O2+3H2SO4=Ce2(SO4)3+O2↑+4H2O,滤渣2为SiO2;滤液2加入NaOH并通入氧气将Ce从+3氧化为+4后Ce3+转化为沉淀Ce(OH)4,反应为:4Ce3++O2+12OH-+2H2O═4Ce(OH)4↓,加热分解Ce(OH)4得到产品CeO2。
(1)已知:CeO2不溶于强酸强碱,废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)中SiO2也不溶于强酸,加入稀硫酸可将CeO2和SiO2与Fe2O3、FeO分离,稀酸为H2SO4;滤渣2为SiO2;
(2)滤液1中加入H2O2溶液的目的是使Fe2+氧化为Fe3+;滤渣1中加入H2O2,主要利用了H2O2的还原性;
(3)酸性环境下,2CeO2+H2O2+6H+=2Ce3++O2↑+4H2O,CeO2中Ce元素化合价从+4变为+3,化合价降低,被还原,发生还原反应,CeO2作氧化剂,其氧化性:CeO2> H2O2,2Fe2++H2O2+2H+=2Fe3++2H2O,H2O2中O元素的化合价从-1变为-2,化合价降低,被还原,发生还原反应,H2O2作氧化剂,其氧化性:H2O2> Fe3+,所以氧化性:CeO2> H2O2> Fe3+;
(4)液2加入NaOH并通入氧气将Ce从+3氧化为+4后Ce3+转化为沉淀Ce(OH)4,滤液2生成Ce(OH)4的离子方程式为:4Ce3++O2+12OH-+2H2O═4Ce(OH)4↓
(5)硫酸铁铵矾[NH4Fe(SO4)212H2O]广泛用于水的净化处理,Fe3+的水解生成具有吸附作用的Fe(OH)3胶体,其离子方程式为:Fe3++3H2OFe(OH)3(胶体)+3H+
(6)Ce(OH)4 ~ FeSO4
0.0025mol 0.1000mol/L-1×0.025L
所以m(Ce(OH)4 )= 0.025mol×208g/mol = 5.2g,
产品中Ce(OH)4的质量分数为:![]() %。
%。

【题目】X、Y、Z、W为四种常见元素,其中X、Y、Z为短周期元素。有关信息如表所示.
原子或分子相关信息 | 单质或化合物相关信息 | |
X |
| X的最高价氧化物对应的水化物为无机酸中的最强酸 |
Y | Y原子的最外层电子数等于电子层数 | Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料 |
Z | Z原子的最外层电子数是次外层电子数的 | Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料 |
W | W原子的最外层电子数小于4 | W的常见化合价有 |
(1)W在周期表中的位置为______,![]() 在空气中不稳定,极易被氧化,由白色迅速变成灰绿色,最后变成红褐色,反应的化学方程式为______
在空气中不稳定,极易被氧化,由白色迅速变成灰绿色,最后变成红褐色,反应的化学方程式为______
(2)X的简单阴离子的结构示意图为______,X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为________
(3)Z的氧化物在通讯领域用来作______,工业上制备Z的单质的化学反应方程式为______。锗与Z是同一主族元素,它可用来制造半导体品体管.研究表明:有机锗具有明显的抗肿瘤活性,锗不与![]() 溶液反应但在有
溶液反应但在有![]() 存在时可与
存在时可与![]() 溶液反应生成锗酸盐,反应的化学方程式为_______
溶液反应生成锗酸盐,反应的化学方程式为_______