题目内容
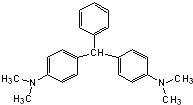
【题目】M是苯的同系物,其结构为![]() ,则M的结构式共有( )
,则M的结构式共有( )
A.6种B.24种C.36种D.64种
【答案】C
【解析】
根据戊烷同分异构体利用等效氢判断C5H11—为8种,分别为: CH3CH2CH2CH2CH2—、CH3CH2CH2(CH3)CH—、(CH3CH2)2CH—、CH3CH(CH3)CH2CH2—、CH3CH(CH3)CH(CH3)—、—C(CH3)2CH2CH3、—CH2CH(CH3)CH2CH3、(CH3)3CCH2—。结合有机物结构苯环对位上的两个戊基可以是相同的也可以是不同的,当左边为:CH3CH2CH2CH2CH2—时,右边可以连的戊基有8种;当左边为:CH3CH2CH2(CH3)CH—时,排除重复结构,右边可以连的戊基有7种;当左边为:(CH3CH2)2CH—时,排除重复结构,右边可以连的戊基有6种;当左边戊基为:CH3CH(CH3)CH2CH2—时,排除重复结构,右边可以连的戊基有5种;当左边戊基为:CH3CH(CH3)CH(CH3)—时,排除重复结构,右边可以连的戊基有4种;当左边戊基为:—C(CH3)2CH2CH3时,排除重复结构,右边可以连的戊基有3种;当左边戊基为:—CH2CH(CH3)CH2CH3时,排除重复结构,右边可以连的戊基有2种;当左边戊基为:(CH3)3CCH2﹣时,排除重复结构,右边可以连的戊基有1种,共计36种;
答案选C。

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案【题目】碳、氮是中学化学重要的非金属元素,在生产、生活中有广泛的应用。
(1)治理汽车尾气中NO和CO的一种方法是:在汽车的排气管道上安装一个催化转化装置,使NO与CO反应,产物都是空气中的主要成分。写出该反应的热化学方程式___。
已知:①N2(g)+O2(g)=2NO(g) △H=+179.5kJ/mol
②2NO(g)+O2(g)=2NO2(g) △H=-112.3kJ/mol
③NO2(g)+CO(g)=NO(g)+CO2(g) △H=-234kJ/mol
(2)己知植物光合作用发生的反应如下:
6CO2(g)+6H2O(l)![]() C6H12O6(s)+6O2(g) △H=+669.62 kJ/mol
C6H12O6(s)+6O2(g) △H=+669.62 kJ/mol
该反应达到化学平衡后,若改变下列条件,CO2转化率增大的是___。
a.增大CO2的浓度 b.取走一半C6H12O6 c.加入催化剂 d.适当升高温度
(3)N2O5的分解反应2N2O5(g)![]() 4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
4NO2(g)+O2(g),由实验测得在67℃时N2O5的浓度随时间的变化如下:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
C(N2O5)/(mol·L-1) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
计算在0~2min时段,化学反应速率v(NO2)=___molL-1min-1。
(4)新的研究表明,可以将CO2转化为炭黑进行回收利用,反应原理如图所示。
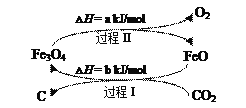
①在转化过程中起催化作用的物质是___;
②写出总反应的化学方程式___。
(5)工业上以NH3和CO2为原料合成尿素[CO(NH2)2),反应的化学方程式如下:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(l)根据上述反应,填写下列空白
CO(NH2)2(l)+H2O(l)根据上述反应,填写下列空白
①己知该反应可以自发进行,则△H___0。(填“>”、“<”或“=”);
②一定温度和压强下,若原料气中的NH3和CO2的物质的量之比![]() =x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是___;B点处,NH3的平衡转化率为___。
=x,如图是x与CO2的平衡转化率(α)的关系。α随着x增大而增大的原因是___;B点处,NH3的平衡转化率为___。
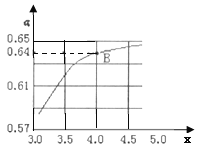
③一定温度下,在3L定容密闭容器中充入NH3和CO2,若x=2,当反应后气体压强变为起始时气体压强的![]() 时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=___。
时达到平衡,测得此时生成尿素90g。该反应的平衡常数K=___。