题目内容
【题目】某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B═H++HB-;HB-![]() H++B2-,回答下列问题:
H++B2-,回答下列问题:
(1)NaHB溶液显___________(填“酸性”、“中性”或“碱性”或“酸碱性无法确定”),理由是___________。
(2)某温度下,向0.1mol/L的NaHB溶液中滴入0.1mol/LKOH溶液至中性,此时溶液中以下关系一定正确的是___________(填字母).
A.c(H+)c(OH-)═1×10-14 mol2/L2
B.c(Na+)+c(K+)═c(HB-)+2c(A2-)
C.c(Na+)>c(K+)
D.c(Na+)+c(K+)═0.05mol/L
(3)已知常温下H2B的钙盐(CaB)饱和溶液中存在以下平衡:CaB(s) ![]() Ca2+(aq)+B2-(aq)△H>0.
Ca2+(aq)+B2-(aq)△H>0.
①温度升高时,Ksp ___________(填“增大”、“减小”或“不变”,下同)。
②滴加少量浓盐酸,c(Ca2+)___________,原因是___________(用文字和离子方程式说明)。
(4) 已知0.1molL-1NaHB溶液的pH=2,则0.1molL-1H2B溶液中氢离子的物质的量浓度可能是___________0.11molL-1(填“<”、“>”、或“=”); 理由是___________。
(5)0.1 mol/L NaHB溶液中各种离子浓度由大到小的顺序是___________。
【答案】
(1)酸性;H2B第一步完全电离、第二步部分电离,则HB-只能电离不能水解;
(2)BC;
(3)①增大;
②增大;加盐酸发生反应:B2-+H+![]() HB-,A2-浓度减小,CaB的溶解平衡向右移动,n(Ca2+)显著增大,而溶液体积变化不大,所以c(Ca2+)增大
HB-,A2-浓度减小,CaB的溶解平衡向右移动,n(Ca2+)显著增大,而溶液体积变化不大,所以c(Ca2+)增大
(4)小于;0.1 mol/LNaHB溶液的pH=2,说明其中c(H+)=0.01 mol/L,主要是HB-电离产生的,在H2B溶液中,第一步电离产生的H+抑制了第二步的电离,所以0.1 mol/L H2B溶液中c(H+)<0.11 mol/L
(5)c(Na+)>c(HB-)>c(H+)>c(B2-)>c(OH-).
【解析】
试题分析:(1)H2B第一步完全电离、第二步部分电离,则HB-只能电离不能水解,导致溶液中c(H+)>c(OH-),所以溶液呈酸性;故答案为:酸性;H2B第一步完全电离、第二步部分电离,则HB-只能电离不能水解;
(2)A、水的离子积常数与温度有关,温度越高,水的离子积常数越大,温度未知,所以水的离子积常数也未知,故A错误;B、溶液呈电中性,溶液中阴阳离子所带电荷相等,溶液呈中性,氢离子浓度等于氢氧根离子浓度,所以c(Na+)+c(K+)=c(HB-)+2c(B2-),故B正确;C、NaHB溶液呈酸性,Na2B溶液呈碱性,向0.1mol/L的NaHB溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性时,NaHB的物质的量应大于氢氧化钾的物质的量,所以同一混合溶液中c(Na+)>c(K+),故C正确;D、NaHB溶液呈酸性,Na2B溶液呈碱性,向0.1mol/L的NaHB溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性时,NaHB的体积应大于氢氧化钾的体积,所以c(Na+)+c(K+)>0.05mol/L,故D错误;故答案为:BC;
(3)①该反应为吸热反应,温度升高,平衡正向移动,Ksp增大,故答案为:增大;
②加盐酸发生反应:B2-+H+![]() HB-,B2-浓度减小,CaB的溶解平衡向右移动,n(Ca2+)显著增大,而溶液体积变化不大,所以c(Ca2+)增大,故答案为:增大;加盐酸发生反应:B2-+H+
HB-,B2-浓度减小,CaB的溶解平衡向右移动,n(Ca2+)显著增大,而溶液体积变化不大,所以c(Ca2+)增大,故答案为:增大;加盐酸发生反应:B2-+H+![]() HB-,A2-浓度减小,CaB的溶解平衡向右移动,n(Ca2+)显著增大,而溶液体积变化不大,所以c(Ca2+)增大
HB-,A2-浓度减小,CaB的溶解平衡向右移动,n(Ca2+)显著增大,而溶液体积变化不大,所以c(Ca2+)增大
(4)若0.1molL-1NaHB溶液的pH=2,说明溶液中c(H+)=0.01mol/L,则HB-的电离度是10%,H2B第一步不能完全电离,第二步部分电离,由于H2B第一步电离产生的H+抑制了HB-的电离,故H2B(0.1 mol/L)的c(H+)小于0.11 mol/L,故答案为:小于;
(5)钠离子不电离,HB-能电离,所以c(Na+)>c(HB-),根据(3)知,溶液呈酸性,则c(H+)>c(OH-),水和HB-都电离出氢离子,则c(H+)>c(B2-),所以该溶液中离子浓度大小顺序是c(Na+)>c(HB-)>c(H+)>c(B2-)>c(OH-),故答案为:c(Na+)>c(HB-)>c(H+)>c(B2-)>c(OH-).

【题目】下表是元素周期表的一部分,所列字母分别代表一种元素:
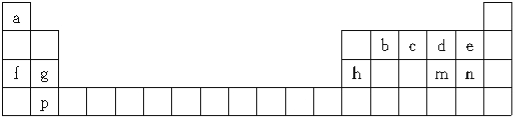
(1)m元素在周期表中的位置是 。
(2)下列有关说法正确的是 (填字母)。
A.b、c、d元素的非金属性逐渐增大 |
B.f、g、h元素的原子半径逐渐减小 |
C.md2与bd2的化学性质类似,都具有氧化性 |
D.e、n的最高价含氧酸的酸性强弱:e>n |
E.a、f分别与d组成的化合物中所含化学键类型完全相同
F.该表中只有4种元素组成的单质具有导电性
(3)a、c、n按原子个数比为4:1:1构成的化合物是 。
【题目】下表列出了①~⑨九种元素在周期表中的位置:
ⅠA | ||||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑧ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑨ | ||||
请按要求回答下列问题。
(1)元素⑧的名称是______,元素⑧在周期表中所处位置___________。元素④的氢化物沸点高于⑦的氢化物沸点,原因是_________________________________________。
(2)④⑥⑦的氢化物按稳定性由弱到强的顺序是________________________(写氢化物的化学式)。
(3)元素②④形成原子个数比为1:2的化合物的电子式是 。
(4)元素②形成的一类氢化物称为烷烃,通式是___________,其中 (填分子式)有两种同分异构体,结构简式分别是____________________________________。
(5)用电子式表示⑤与⑦形成化合物的过程_________________________。