题目内容
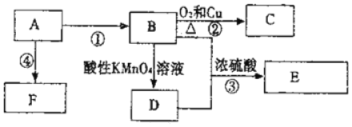
【题目】已知:A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平,E是具有果香味的有机物,F是一种高聚物,可制成多种包装材料。

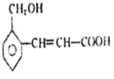
(1)A的结构式为______。
(2)B分子中的官能团名称是______,C的名称为______。
(3)写出下列反应的化学方程式:
①__ ___。
③___ ___。
【答案】(1)CH2=CH2;(2)羟基;乙醛;
(3)①CH2 =CH2 + H2O![]() CH3CH2OH;
CH3CH2OH;
③CH3CH2OH+CH3COOH ![]() CH3COOCH2CH3+H2O。
CH3COOCH2CH3+H2O。
【解析】
试题分析:(1)A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平,则A是乙烯,结构简式是CH2=CH2;(2)A与水在一定条件下发生加成反应产生B是乙醇,结构简式是CH3CH2OH,官能团是羟基; B与O2在Cu作催化剂时,在加热条件下发生氧化反应产生C是乙醛,结构简式是CH3CHO;(3)①乙烯与水发生加成反应产生乙醇的反应方程式是:CH2 =CH2 + H2O![]() CH3CH2OH ;B被酸性高锰酸钾溶液氧化产生乙酸,乙醇与乙酸在浓硫酸存在时,在加热条件下发生酯化反应,产生具有水果香味的物质乙酸乙酯和水,该反应的方程式是:CH3CH2OH+CH3COOH
CH3CH2OH ;B被酸性高锰酸钾溶液氧化产生乙酸,乙醇与乙酸在浓硫酸存在时,在加热条件下发生酯化反应,产生具有水果香味的物质乙酸乙酯和水,该反应的方程式是:CH3CH2OH+CH3COOH ![]() CH3COOCH2CH3+H2O;乙烯在一定条件下发生加聚反应产生高聚物——F(聚乙烯),该反应的方程式是:
CH3COOCH2CH3+H2O;乙烯在一定条件下发生加聚反应产生高聚物——F(聚乙烯),该反应的方程式是:![]() 。
。

练习册系列答案
相关题目