题目内容
7.V L含有(NH4)2SO4和K2SO4的混合溶液,已知NH4+浓度为a mol•L-1;SO42-浓度为bmol•L-1.则原混合溶液中钾离子的物质的量浓度为( )| A. | (b-2a) mol•L-1 | B. | $\frac{b-2a}{2}$•L-1 | C. | (2b-a)mol•L-1 | D. | $\frac{2b-a}{2}$ mol•L-1 |
分析 溶液中满足电荷守恒,根据电荷守恒可知:c(K+)+c(NH4+)=2c(SO42-),据此进行计算原混合溶液中钾离子的物质的量浓度.
解答 解:溶液中NH4+的物质的量浓度为amol•L-1,SO42-的物质的量浓度为bmol•L-1,
根据溶液电荷守可知:c(K+)+c(NH4+)=2c(SO42-),
即:c(K+)+amol•L-1=2×bmol•L-1,
解得:c(K+)=(2b-a)mol•L-1,
故选C.
点评 本题考查混合溶液中离子物质的量浓度的计算,题目难度中等,注意溶液中离子浓度计算中电荷守恒的运用,试题侧重考查学生的分析能力及化学计算能力.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
17.在温度体积不变的条件下发生反应:NO2(g)+SO2(g)?SO3(g)+NO(g)将NO2与SO2以体积比3:1置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是( )
| A. | 混合气体密度保持不变 | B. | 体系压强保持不变 | ||
| C. | SO2和NO的体积比保持不变 | D. | 每消耗1mol SO2的同时生成1molNO |
18. 在做测定空气中氧气含量的实验中,小亮同学设计如下图所示的装置(注射器中装有水,注射器活塞能自由移动),对此装置评价错误的是( )
在做测定空气中氧气含量的实验中,小亮同学设计如下图所示的装置(注射器中装有水,注射器活塞能自由移动),对此装置评价错误的是( )
 在做测定空气中氧气含量的实验中,小亮同学设计如下图所示的装置(注射器中装有水,注射器活塞能自由移动),对此装置评价错误的是( )
在做测定空气中氧气含量的实验中,小亮同学设计如下图所示的装置(注射器中装有水,注射器活塞能自由移动),对此装置评价错误的是( )| A. | 该装置能使测量空气中氧气含量更精确 | |
| B. | 此装置可以直接测出瓶中原有的氧气质量 | |
| C. | 在探究中可以领悟科学研究的严密性和趣味性 | |
| D. | 此装置不使用导管,所以避免了反应后导管中的空气进入瓶中引起误差,又避免了导管中留有一定量的水引起误差 |
15.下列电离方程式正确的是( )
| A. | CaCl2═Ca2++Cl2? | B. | H2SO4═2 H++SO42- | ||
| C. | Ba(OH)2═Ba++2 OH- | D. | Na HCO3═Na++H++CO32- |
2.将等物质的量浓度、等体积的Ba(OH)2溶液与盐酸混合后,滴入紫色石蕊试液,溶液呈( )
| A. | 紫色 | B. | 红色 | C. | 蓝色 | D. | 无色 |
17.下列铝及其化合物的性质和应用的说法正确的是( )
| A. | 铝箔插入稀HNO3中,无现象,说明铝箔表面被HNO3氧化,形成致密的氧化膜 | |
| B. | 加入铝粉能产生H2的溶液中,可能存在大量的Na+、Ba2+、AlO2-、NO3- | |
| C. | 明矾可用于水的消毒,杀菌 | |
| D. | 向NaAlO2溶液中通入过量CO2的离子方程式为2AlO${\;}_{2}^{-}$+CO2+3H2O═2Al(OH)3↓+CO${\;}_{3}^{2-}$ |
 3,3,5,5-四甲基庚烷;
3,3,5,5-四甲基庚烷; ;
;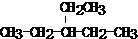 .
.