题目内容
17.在温度体积不变的条件下发生反应:NO2(g)+SO2(g)?SO3(g)+NO(g)将NO2与SO2以体积比3:1置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是( )| A. | 混合气体密度保持不变 | B. | 体系压强保持不变 | ||
| C. | SO2和NO的体积比保持不变 | D. | 每消耗1mol SO2的同时生成1molNO |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、反应前后混合气体质量、体积都不变,所以密度一直不变,则密度保持不变不能说明达平衡状态,故A错误;
B、体系的压强始终不变,故不能说明达平衡状态,故B错误;
C、NO2与SO2以体积比3:1置于密闭容器中发生上述反应,SO3和NO的体积消耗按照1:1进行,所以SO2和NO的体积比保持不变,能说明达平衡状态,故C正确;
D、每消耗1 mol SO2的同时生成1 mol NO,只要反应发生一直符合这一关系,故D错误;
故选C.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
7.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 1mol H2O中含有的原子数为NA | |
| B. | 2g H2中含有的氢原子数为2NA | |
| C. | 常温常压下,11.2L N2中含有的分子数为0.5N A | |
| D. | 1L 0.1 mol/L NaNO3溶液中含有的钠离子数为NA |
8.化学在生产和生活中有着广泛的应用.下列说法错误的是( )
| A. | 二氧化硫在食品加工中可用作食品增白剂 | |
| B. | 航天飞机上的隔热陶瓷瓦属于复合材料 | |
| C. | 用活性炭做净化剂除去冰箱中异味 | |
| D. | 含H2SO4的废水用BaCl2处理后不可直接排放 |
5.如图实验能达到实验目的且符合安全要求的是( )
| A. | 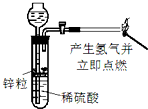 制备并检验氢气的可燃性 | B. | 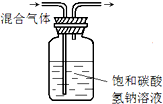 除去CO2中的HCl | ||
| C. | 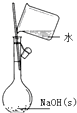 配置一定物质的量浓度的NaOH溶液 | D. |  制备氢氧化亚铁并观察其颜色 |
12.下列变化过程中,△S<0的是( )
| A. | 氨气与氯化氢合成氯化铵 | B. | 氢气与氯气合成氯化氢 | ||
| C. | 蔗糖溶于水 | D. | 加热KMnO4分解制O2 |
9.在三个密闭容器中分别充入氦气、氧气、氮气,当它们的温度和密度都相同时,这三种气体的压强(P)从大到小的顺序是( )
| A. | 氦气>氧气>氮气 | B. | 氧气>氮气>氦气 | C. | 氧气>氦气>氮气 | D. | 氦气>氮气>氧气 |
6.某溶液中含K+、Al3+、NH4+、SO42-.取500mL该溶液加入过量的氢氧化钡溶液,经过滤、洗涤、干燥,称重得到9.32g固体1,并收集到224mL(标准状况)气体.在滤液中通入过量的CO2,经过滤、洗涤、灼烧,称重得到0.51g固体2.原溶液中K+的浓度为( )
| A. | 0.08mol/L | B. | 0.04mol/L | C. | 0.02mol/L | D. | 0.01mol/L |
7.V L含有(NH4)2SO4和K2SO4的混合溶液,已知NH4+浓度为a mol•L-1;SO42-浓度为bmol•L-1.则原混合溶液中钾离子的物质的量浓度为( )
| A. | (b-2a) mol•L-1 | B. | $\frac{b-2a}{2}$•L-1 | C. | (2b-a)mol•L-1 | D. | $\frac{2b-a}{2}$ mol•L-1 |