题目内容
15.下列电离方程式正确的是( )| A. | CaCl2═Ca2++Cl2? | B. | H2SO4═2 H++SO42- | ||
| C. | Ba(OH)2═Ba++2 OH- | D. | Na HCO3═Na++H++CO32- |
分析 A.氯离子不能合写;
B.硫酸为强电解质,完全电离;
C.钡离子为+2价离子;
D.碳酸氢根离子为弱酸的酸式根离子,不能拆.
解答 解:A.氯化钙为强电解质,完全电离,电离方程式:CaCl2═Ca2++2Cl?,故A错误;
B.硫酸为强电解质,完全电离,电离方程式:2SO4═2 H++SO42-,故B正确;
C.硫a(OH)2为强电解质,完全电离,电离方程式:Ba(OH)2═Ba+++2 OH-,故C错误;
D.碳酸氢钠为强电解质,完全电离,电离方程式:Na HCO3═Na++HCO3-,故D错误;
故选:B.
点评 本题考查了电解质电离方程式的书写,明确电解质的强弱是解题关键,注意离子符号的正确书写.

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目
5.如图实验能达到实验目的且符合安全要求的是( )
| A. | 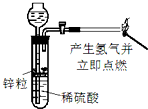 制备并检验氢气的可燃性 | B. | 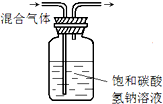 除去CO2中的HCl | ||
| C. | 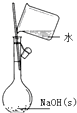 配置一定物质的量浓度的NaOH溶液 | D. |  制备氢氧化亚铁并观察其颜色 |
6.某溶液中含K+、Al3+、NH4+、SO42-.取500mL该溶液加入过量的氢氧化钡溶液,经过滤、洗涤、干燥,称重得到9.32g固体1,并收集到224mL(标准状况)气体.在滤液中通入过量的CO2,经过滤、洗涤、灼烧,称重得到0.51g固体2.原溶液中K+的浓度为( )
| A. | 0.08mol/L | B. | 0.04mol/L | C. | 0.02mol/L | D. | 0.01mol/L |
10.下列各组物质按酸、碱、盐、电解质分类顺序排列的是( )
| A. | 硫酸、纯碱、明矾、二氧化硫 | B. | 硝酸、烧碱、碳酸钙、氯化钠 | ||
| C. | 醋酸、苛性钠、碳酸钠、氨水 | D. | 盐酸、熟石灰、苛性钠、乙醇 |
20.同温同压下两个容积相等的贮气瓶,一个装有C2H4气体,另一个装有C2H2和C2H6的混合气体,两瓶内的气体可能不相同的是( )
| A. | 物质的量 | B. | 原子总数 | C. | 碳原子数 | D. | 分子数 |
7.V L含有(NH4)2SO4和K2SO4的混合溶液,已知NH4+浓度为a mol•L-1;SO42-浓度为bmol•L-1.则原混合溶液中钾离子的物质的量浓度为( )
| A. | (b-2a) mol•L-1 | B. | $\frac{b-2a}{2}$•L-1 | C. | (2b-a)mol•L-1 | D. | $\frac{2b-a}{2}$ mol•L-1 |
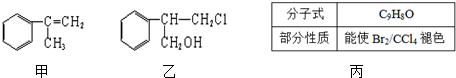
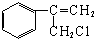 $→_{Ⅱ}^{一定条件}$Y$→_{Ⅲ}^{一定条件}$乙
$→_{Ⅱ}^{一定条件}$Y$→_{Ⅲ}^{一定条件}$乙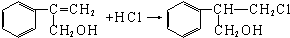 _(不需注明反应条件).
_(不需注明反应条件).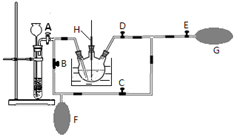 高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:
高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下: