题目内容
17.下列铝及其化合物的性质和应用的说法正确的是( )| A. | 铝箔插入稀HNO3中,无现象,说明铝箔表面被HNO3氧化,形成致密的氧化膜 | |
| B. | 加入铝粉能产生H2的溶液中,可能存在大量的Na+、Ba2+、AlO2-、NO3- | |
| C. | 明矾可用于水的消毒,杀菌 | |
| D. | 向NaAlO2溶液中通入过量CO2的离子方程式为2AlO${\;}_{2}^{-}$+CO2+3H2O═2Al(OH)3↓+CO${\;}_{3}^{2-}$ |
分析 A、常温下铝在浓硝酸、浓硫酸中发生钝化;
B、加入铝粉能产生H2的溶液可能为酸或碱,酸溶液中硝酸根存在,不会生成氢气,碱溶液中离子可以共存;
C、明矾溶于水,溶液中铝离子水解生成氢氧化铝胶体,能净水但不能杀菌消毒;
D、过量二氧化碳和偏铝酸钠溶液中反应生成碳酸氢钠和氢氧化铝沉淀.
解答 解:A、常温下铝在浓硝酸、浓硫酸中发生钝化,稀硝酸中铝发生反应,不能发生钝化,故A错误;
B、加入铝粉能产生H2的溶液可能为酸或碱,酸溶液中硝酸根存在,不会生成氢气,酸溶液中AlO2-会生成氢氧化铝沉淀,酸溶液中不能共存,但碱溶液中可以共存,故B正确;
C、明矾溶于水,溶液中铝离子水解生成氢氧化铝胶体具有较大的表面积,能吸附杂质能净水,但不能杀菌消毒,故C错误;
D、过量二氧化碳和偏铝酸钠溶液中反应生成碳酸氢钠和氢氧化铝沉淀,反应的离子方程式为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故D错误;
故选B.
点评 本题考查了物质性质,离子水解原理、离子共存的分析应用,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
7.V L含有(NH4)2SO4和K2SO4的混合溶液,已知NH4+浓度为a mol•L-1;SO42-浓度为bmol•L-1.则原混合溶液中钾离子的物质的量浓度为( )
| A. | (b-2a) mol•L-1 | B. | $\frac{b-2a}{2}$•L-1 | C. | (2b-a)mol•L-1 | D. | $\frac{2b-a}{2}$ mol•L-1 |
8.将下列各组物质按酸、碱、盐分类顺次排列,其中正确的是( )
| A. | 硫酸 纯碱 烧碱 | B. | 硝酸 烧碱 氯化钠 | ||
| C. | 醋酸 酒精 碳酸钙 | D. | 盐酸 熟石灰 苛性钠 |
12.氧化铝熔点很高,常用于制造耐火材料,例如制作坩埚,下列操作不能在氧化铝坩埚中进行的是( )
| A. | 加热使CuSO4•5H2O失水 | B. | 加热使KMnO4分解 | ||
| C. | 加热熔化烧碱 | D. | 加热分解碱式碳酸铜 |
3.下列反应的离子方程式中正确的是( )
| A. | 碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH${\;}_{4}^{+}$+OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| B. | Ca(HCO3)2溶液中滴加少量NaOH溶液 Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| C. | NaHSO4溶液和Ba(OH)2溶液充分反应后溶液呈中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| D. | 向Fe(OH)2中加入稀硝酸:3Fe2++4H++NO${\;}_{3}^{-}$═3Fe3++NO↑+2H2O |
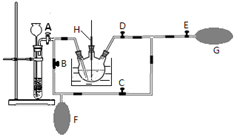 高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:
高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:
 对叔丁基苯酚(
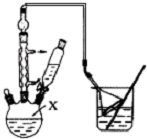
对叔丁基苯酚(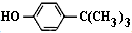 )工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯等为原料制备对叔丁基苯酚.
)工业用途广泛,可用于生产油溶性酚醛树脂、稳定剂和香料等.实验室以苯酚、叔丁基氯等为原料制备对叔丁基苯酚. .
.