题目内容
12.为测定某石灰石样品的纯度,称取4.5g石灰石,加入未知浓度的盐酸直到不再产生气体(杂质不与盐酸反应),消耗盐酸50mL,生成二氧化碳气体896mL(标准状况).求(1)盐酸的物质的量浓度
(2)石灰石样品的纯度(用百分数表示且保留小数点后一位)
分析 发生反应:CaCO3+2HCl=CaCl2+CO2↑+H2O,根据n=$\frac{V}{{V}_{m}}$计算二氧化碳物质的量,再根据方程式计算碳酸钙、HCl的物质的量,根据c=$\frac{n}{V}$计算盐酸浓度,根据m=nM计算碳酸钙质量,进而计算样品中碳酸钙纯度.
解答 解:标况下,896mL二氧化碳物质的量为$\frac{0.896L}{22.4L/mol}$=0.04mol,
CaCO3+2 HCl=CaCl2+CO2↑+H2O
1 1 1
0.04mol 0.08mol 0.04mol
故盐酸的物质的量浓度为$\frac{0.08mol}{0.05L}$=1.6mol/L,
碳酸钙质量为0.04mol×100g/mol=4g,故石灰石样品的纯度为$\frac{4g}{4.5g}$×100%=88.9%,
答:(1)盐酸的物质的量浓度为1.6mol/L;
(2)石灰石样品的纯度为88.9%.
点评 本题考查化学方程式计算,比较基础,旨在考查学生对基础知识的理解掌握.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
20.同温同压下两个容积相等的贮气瓶,一个装有C2H4气体,另一个装有C2H2和C2H6的混合气体,两瓶内的气体可能不相同的是( )
| A. | 物质的量 | B. | 原子总数 | C. | 碳原子数 | D. | 分子数 |
7.V L含有(NH4)2SO4和K2SO4的混合溶液,已知NH4+浓度为a mol•L-1;SO42-浓度为bmol•L-1.则原混合溶液中钾离子的物质的量浓度为( )
| A. | (b-2a) mol•L-1 | B. | $\frac{b-2a}{2}$•L-1 | C. | (2b-a)mol•L-1 | D. | $\frac{2b-a}{2}$ mol•L-1 |
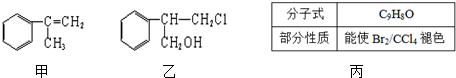
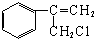 $→_{Ⅱ}^{一定条件}$Y$→_{Ⅲ}^{一定条件}$乙
$→_{Ⅱ}^{一定条件}$Y$→_{Ⅲ}^{一定条件}$乙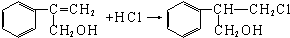 _(不需注明反应条件).
_(不需注明反应条件).