题目内容
5.天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷.(1)工业上可用煤制天然气,生产过程中有多种途径生成CH4.
①写出CO2与H2反应生成CH4和H2O的热化学方程式CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H=-162kJ•mol-1
已知:CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41kJ•mol-1
C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1
2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1
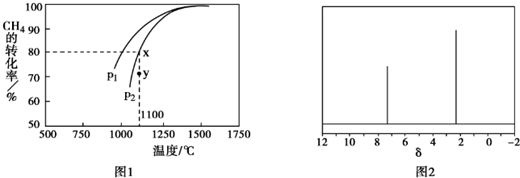
②科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以CO2和H2O合成CH4.

写出铜电极表面的电极反应式CO2+8e-+8H+=CH4+2H2O.为提高该人工光合系统的工作效率,可向装置中加入少量硫酸(选填“盐酸”或“硫酸”).
③另一生成CH4的途径是CO(g)+3H2(g)?CH4(g)+H2O(g).某温度下,将0.1mol CO和0.3molH2充入10L的密闭容器内发生反应CO(g)+3H2(g)?CH4(g)+H2O(g),平衡时H2的转化率为80%,求此温度下该反应的平衡常数K=1.5×105.(计算结果保留两位有效数字)
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS.一定条件下向NH4HS溶液中通入
空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式2NH4HS+O2=2NH3•H2O+2S↓.
(3)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g)═2CO(g)+2H2(g).
在密闭容器中通入物质的量浓度均为0.1mol•L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如图1所示,则压强P1小于P2(填“大于”
或“小于”);压强为P2时,在Y点:v(正)大于v(逆)(填“大于”、“小于”或“等于”).
(4)天然气也可重整生产化工原料,最近科学家们利用天然气无氧催化重整获得芳香烃X.由质谱分析得X的相对分子质量为106,其核磁共振氢谱如图2,则X的结构简式为
 .
.
分析 (1)①根据盖斯定律书写目标热化学方程式;
②由电池装置图可知,Cu上二氧化碳得电子生成甲烷;根据酸的挥发性分析;
③计算平衡时氢气浓度变化量,利用三段式计算平衡时各组分浓度,代入平衡常数表达式计算;
(2)NH4HS中硫元素为-2价,具有还原性能被氧气氧化为硫单质;
(3)该反应正向为体积增大的方向,压强越大,CH4的转化率越小;压强为P2时,在Y点反应未达到平衡,则反应正向移动;
(4)已知X的相对分子质量为l06,设其分子式为CxHy,由$\frac{106}{12}$可知x=8,y=10,再根据质谱图中有2个峰,判断分子中含有2种环境的H.
解答 解:(1)①已知:①CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41kJ•mol-1
②C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1
③2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1
根据盖斯定律,②+③-①×2得:CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H=-162kJ•mol-1,
故答案为:CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H=-162kJ•mol-1;
②由电池装置图可知,Cu上二氧化碳得电子生成甲烷,则Cu电极上的电极反应为:CO2+8e-+8H+=CH4+2H2O;可向装置中加入少量的酸作电解质,由于盐酸易挥发,生成的甲烷中会混有HCl气体,所以选用硫酸,不用盐酸;
故答案为:CO2+8e-+8H+=CH4+2H2O;硫酸;
③平衡时H2的转化率为80%,参加反应氢气的物质的量=0.3mol×80%=0.24mol,故氢气的浓度变化量=$\frac{0.24mol}{10L}$=0.024mol/L,则:
CO(g)+3H2(g)?CH4(g)+H2O(g)
开始(mol/L):0.01 0.03 0 0
变化(mol/L):0.008 0.024 0.008 0.008
平衡(mol/L):0.002 0.006 0.008 0.008
故平衡常数=$\frac{0.008×0.008}{0.002×0.00{6}^{3}}$=1.5×105,
故答案为:1.5×105;
(2)NH4HS中硫元素为-2价,具有还原性能被氧气氧化为硫单质,则一定条件下向NH4HS溶液中通入空气,得到单质硫和氨水,则反应方程式为:2NH4HS+O2=2NH3•H2O+2S↓;
故答案为:2NH4HS+O2=2NH3•H2O+2S↓;
(3)该反应正向为体积增大的方向,压强越大,CH4的转化率越小,已知相同温度下,P1条件下的转化率大于P2,则P1小于P2;压强为P2时,在Y点反应未达到平衡,则反应正向移动,所以v(正)大于v(逆);
故答案为:小于;大于;
(4)芳香烃X,已知X的相对分子质量为l06,设其分子式为CxHy,由$\frac{106}{12}$可知x=8,y=10,说明分子中含有一个苯环,另外含有2个C原子,再根据质谱图中有2个峰,可知分子中含有2种环境的H,则分子结构对称,所以其结构简式为 ,故答案为:
,故答案为: .
.
点评 本题考查了盖斯定律、原电池原理、方程式的书写、化学平衡常数、平衡移动、有机物分子式的确定等,题目涉及的知识点较多,侧重于考查学生对基础知识的综合应用能力,题目难度中等.

| A. | v(NH3)=0.2 mol•L-1•s-1 | B. | v(N2)=0.2 mol•L-1•min-1 | ||
| C. | v(H2)=0.2 mol•L-1•min-1 | D. | v(H2)=0.3 mol•L-1•min-1 |
| A. | (NH4)2SO3 | B. | NH4Cl | C. | (NH4)2CO3 | D. | (NH4)3PO4 |
 学生设计了下图所示的方法对A盐进行鉴定
学生设计了下图所示的方法对A盐进行鉴定由此分析,下列结论中,正确的是( )
| A. | A中一定有Fe3+ | B. | C中一定有Cu2+ | ||
| C. | B一定为AgCl沉淀 | D. | A一定为CuCl2溶液 |
| A. | pH=6的溶液 | B. | 能与金属Al反应放出H2的溶液 | ||
| C. | 遇酚酞显无色的溶液 | D. | c(H+)>c(OH-)的溶液 |
| A. | 反应中共转移3 mol电子 | B. | 反应中共消耗1.8 mol H2SO4 | ||
| C. | 反应中共消耗97.5 g Zn | D. | 气体甲中SO2与H2的体积比为4:1 |
 .
.