题目内容
18.下列物质中含离子键的是( )| A. | HCl | B. | NaF | C. | CH4 | D. | NH3 |
分析 活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,碱金属族元素、碱土金属元素和第VIA族、第VIIA族元素之间易形成离子键,据此分析解答.
解答 解:A.HCl分子中H-Cl原子之间只存在共价键,故A错误;
B.NaF中钠离子和氟离子之间只存在离子键,故B正确;
C.甲烷分子中C-H原子之间只存在共价键,故C错误;
D.氨气分子中N-H原子之间只存在共价键,故D错误;
故选B.
点评 本题考查离子键和共价键的判断,侧重考查基本概念,明确物质的构成微粒即可解答,注意二者区别.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 1.0 mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 使石蕊呈红色的溶液:NH4+、Ba2+、ClO-、Cl- | |
| C. | 使酚酞呈红色的溶液:K+、Na+、CH3COO-、Br- | |
| D. | 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- |
9.实验室中某些气体的制取、除杂及收集装置如图所示.仅用此装置和表中提供的物质完成相关实验,最合理的是( )
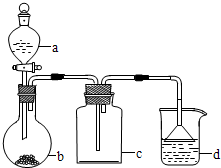

| 选项 | a种物质 | b种物质 | c种物质 | d中收集的气体 |
| A | 浓氨水 | NaOH | 浓硫酸 | NH3 |
| B | 稀盐酸 | CaCO3 | 浓硫酸 | CO2 |
| C | 稀硝酸 | Cu | 碱石灰 | NO |
| D | 浓盐酸 | KMnO4 | 水 | Cl2 |
| A. | A | B. | B | C. | C | D. | D |
13.反应N2+3H2?2NH3刚开始时只通入N2和H2且N2的浓度为3mol•L-1,H2的浓度为5mol•L-1,5min后测得NH3浓度为 1 mol•L-1,则此时间内,下列反应速率表示正确的是( )
| A. | v(NH3)=0.2 mol•L-1•s-1 | B. | v(N2)=0.2 mol•L-1•min-1 | ||
| C. | v(H2)=0.2 mol•L-1•min-1 | D. | v(H2)=0.3 mol•L-1•min-1 |
3.同周期的X、Y、Z三种元素,它们的气态氢化物的化学式分别为H2X、YH3、ZH4,下列说法正确的是( )
| A. | 气态氢化物的稳定性按X、Y、Z的顺序递增 | |
| B. | 三种元素的最高价氧化物对应的水化物酸性:H2ZO3>H3YO4>H2XO4 | |
| C. | 元素的最高正化合价按X、Y、Z的顺序递增 | |
| D. | 元素原子的半径按X、Y、Z的顺序递增 |
10. 学生设计了下图所示的方法对A盐进行鉴定
学生设计了下图所示的方法对A盐进行鉴定
由此分析,下列结论中,正确的是( )
 学生设计了下图所示的方法对A盐进行鉴定
学生设计了下图所示的方法对A盐进行鉴定由此分析,下列结论中,正确的是( )
| A. | A中一定有Fe3+ | B. | C中一定有Cu2+ | ||
| C. | B一定为AgCl沉淀 | D. | A一定为CuCl2溶液 |
7.在无色透明的强酸性溶液中,能大量共存的离子组是( )
| A. | Na+、Mg2+、NO3-、SO32- | B. | K+、Cl-、NO3-、Fe2+ | ||
| C. | NH4+、Al3+、NO3-、SO42- | D. | K+、Na+、HCO3-、NO3- |

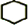 ,B名称是1,2-二溴环己烷
,B名称是1,2-二溴环己烷 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$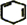 +2NaBr+2H2O.
+2NaBr+2H2O.