题目内容
1.以色列科学家达尼埃尔•谢赫特曼因发现“准晶体”独获2011年诺贝尔化学奖.某准晶体W由一定比例的铁、铜、铝组成,取两小块该准晶体:一块投入烧杯①中,注入浓氢氧化钠溶液浸没固体;另一块投入烧杯②中,注入稀硫酸浸没固体.下列分析合理的是( )| A. | 烧杯①中,若构成微型电池,负极反应式为2Al-6e-=2Al3+,正极反应式为 6H++6e-=3H2↑ | |
| B. | 烧杯①中,若将电解质溶液换成浓硝酸,构成微型电池时铝为负极,铜为正极 | |
| C. | 烧杯②中,若铁、铜构成微型电池,则铁为负极;若铝、铁构成微型电池,则铁为正极 | |
| D. | 烧杯②中,固体最终完全溶解,溶液呈蓝色.向溶液中滴加KSCN溶液,溶液不变色 |
分析 在烧杯①中,若构成微型电池,则铝作负极,铁或铜作正极,负极上铝失电子发生氧化反应,正极上得电子发生还原反应,在烧杯②中,若构成原电池,则铝或铁作负极,则铁或铜作正极,负极上活泼金属失电子发生氧化反应,正极上氢离子得电子发生还原反应,据此分析.
解答 解:A.在烧杯①中,若构成微型电池,电解质溶液为氢氧化钠,负极反应式为:2Al-6e-+8OH-=2AlO2-+4H2O,故A错误;
B.在烧杯①中,若将电解质溶液换成浓硝酸,铝与浓硝酸发生钝化反应,则铝为正极,铜为负极,故B错误;
C.较活泼金属为负极,则在烧杯②中,若铁、铜构成微型电池,则铁为负极;若铝、铁构成微型电池,则铁为正极,故C正确;
D.稀硫酸与铜不反应,不可能生成硫酸铜,故D错误.
故选C.
点评 本题考查原电池原理,为高频考点,侧重于学生的分析能力的考查,注意在原电池中要注意电解质溶液的酸碱性与金属的性质,要根据得失电子判断正负极,为易错点.

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
11.下列说法不正确的是( )
| A. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| B. | 用甘氨酸和丙氨酸缩合最多可形成4种二肽 | |
| C. | 分子式为C5H8O2,既能与Na2CO3溶液反应又能与溴的四氯化碳溶液反应的有机物有8种 | |
| D. | 乳酸薄荷醇酯( )能发生水解、氧化、消去反应 )能发生水解、氧化、消去反应 |
9.实验室中某些气体的制取、除杂及收集装置如图所示.仅用此装置和表中提供的物质完成相关实验,最合理的是( )
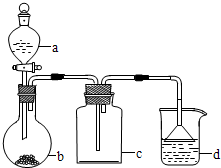

| 选项 | a种物质 | b种物质 | c种物质 | d中收集的气体 |
| A | 浓氨水 | NaOH | 浓硫酸 | NH3 |
| B | 稀盐酸 | CaCO3 | 浓硫酸 | CO2 |
| C | 稀硝酸 | Cu | 碱石灰 | NO |
| D | 浓盐酸 | KMnO4 | 水 | Cl2 |
| A. | A | B. | B | C. | C | D. | D |
13.反应N2+3H2?2NH3刚开始时只通入N2和H2且N2的浓度为3mol•L-1,H2的浓度为5mol•L-1,5min后测得NH3浓度为 1 mol•L-1,则此时间内,下列反应速率表示正确的是( )
| A. | v(NH3)=0.2 mol•L-1•s-1 | B. | v(N2)=0.2 mol•L-1•min-1 | ||
| C. | v(H2)=0.2 mol•L-1•min-1 | D. | v(H2)=0.3 mol•L-1•min-1 |
10. 学生设计了下图所示的方法对A盐进行鉴定
学生设计了下图所示的方法对A盐进行鉴定
由此分析,下列结论中,正确的是( )
 学生设计了下图所示的方法对A盐进行鉴定
学生设计了下图所示的方法对A盐进行鉴定由此分析,下列结论中,正确的是( )
| A. | A中一定有Fe3+ | B. | C中一定有Cu2+ | ||
| C. | B一定为AgCl沉淀 | D. | A一定为CuCl2溶液 |
11.下列关于实验的描述错误的是( )
| A. | 将硫酸铜溶液加热蒸发、浓缩、冷却结晶,可以制备硫酸铜晶体 | |
| B. | 测定等浓度NaClO溶液和Na2SO4溶液的pH,比较Cl、S元素的非金属性强弱 | |
| C. | 萃取法除去NaBr溶液中的少量NaI,需要用烧杯、玻璃棒、胶头滴管、分液漏斗 | |
| D. | 检验Na2SO3固体是否被部分氧化:取少量固体溶于水,滴加过量稀盐酸,观察是否产生气泡,再滴加BaCl2溶液,观察是否产生白色沉淀 |
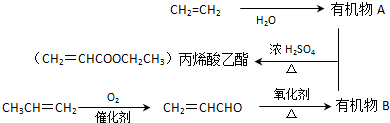
 .
.
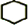 ,B名称是1,2-二溴环己烷
,B名称是1,2-二溴环己烷 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$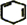 +2NaBr+2H2O.
+2NaBr+2H2O.