题目内容
6.世上的物质往往由不同的元素组成,它们对人类的作用却有“功与过”之分.I.经分析确定车辆气囊中粉末含有Na、Fe、N、O四种元素,当车辆发生碰撞瞬间,安全装置通电点火,使其中的粉末分解释放出大量保护气形成安全气囊.试回答:
(1)氧原子的结构示意图为
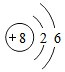 .
.(2)气囊粉末中能释放出保护气的化合物由两种短周期元素组成,且2mol 该物质分解可产生3mol非金属单质和2mol 金属单质.该化合物的化学式为NaN3.
II.经分析确定工业废水中的N、P元素是造成水体富营养化的关键因素.某农药厂排放的废水中常含有较多的NH4+和PO43-,一般可以通过两种方法将其除去.
(3)方法一:将Ca(OH)2或CaO 投加到待处理的废水中,生成磷酸钙,从而进行回收.当处理后的废水中c(Ca2+)=2×10-7 mol•L-1时,溶液中c(PO43-)=5×10-7mol/Lmol•L-1.(已知Ksp[Ca3(PO4)2]=2×10-33)
(4)方法二:在废水中加入镁矿工业废水,就可以生成高品位的磷矿石-鸟粪石(MgNH4PO4),反应的方程式为Mg2++NH4++PO43-=MgNH4PO4↓.该方法中需要控制污水的pH,若pH高于11,鸟粪石的产量会大大降低.其原因可能为当pH高于11时,溶液中的Mg2+、NH4+会与OH-反应生成弱电解质Mg(OH)2、NH3•H2O,从而减少鸟粪石的产量.
分析 Ⅰ.(1)氧原子核外有2个电子层,最外层电子数为6;
(2)2mol 该物质分解可产生3mol非金属单质和2mol 金属单质,1mol化合物含有3mol非金属、1mol金属,应为NaN3;
Ⅱ.(3)利用沉淀溶解平衡常数,计算;
(4)若pH高于11,鸟粪石的产量会大大降低,可能是溶液中的Mg2+、NH4+会与OH-反应.
解答 解:(1)氧原子核外有2个电子层,最外层电子数为6,原子结构示意图为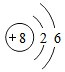 ,故答案为:
,故答案为: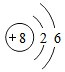 ;
;
(2)2mol 该物质分解可产生3mol非金属单质和2mol 金属单质,1mol化合物含有3mol非金属、1mol金属,应为NaN3,故答案为:NaN3;
(3)Ksp[Ca3(PO4)2]=2×10-33,(2×10-7)3×c2(PO43-)=2×10-33,c(PO43-)=5×10-7 mol/L,故答案为:5×10-7 mol/L;
(4)若pH高于10.7,鸟粪石的产量会大大降低,可能是溶液中的Mg2+、NH4+会与OH-反应,平衡向逆反应方向移动,同时除去废水中的氮,用了镁矿工业废水,
故答案为:当pH高于11时,溶液中的Mg2+、NH4+会与OH-反应生成弱电解质Mg(OH)2、NH3•H2O,从而减少鸟粪石的产量.
点评 本题考查考查较为综合,涉及元素化合物、难容电解质的溶解平衡等,侧重于化学与生活、生产的考查,难度中等,需要学生具备扎实的基础与灵活运用能力.

练习册系列答案
相关题目
16.从海带中制取单质碘需要经过灼烧、溶解、过滤、氧化、萃取、分液、蒸馏等操作.下列图示对应的装置合理,操作规范的是( )
| A. |  灼烧 | B. |  过滤 | ||
| C. |  分液 | D. |  蒸馏 |
14.两种金属混合粉末15g,与足量的盐酸反应时,生成11.2L氢气(标准状况),符合上述的金属混合物是( )
| A. | Mg 和 Ag | B. | Mg和 Al | C. | Cu和 Zn | D. | Fe 和 Zn |
1.随着社会的发展,人们日益重视环境问题,下列说法不正确的是( )
| A. | 绿色化学的核心是利用化学原理从源头上减少和消除化学工业生产对环境的污染 | |
| B. | 对废旧电池进行回收处理主要是为了防止重金属污染水源和土壤 | |
| C. | 采用催化转换技术将汽车尾气中的NOx和CO转化为无毒气体 | |
| D. | PM2.5是指大气中直径接近于2.5×10-6m的细颗粒物,它们分散在空气中形成的混合物具有丁达尔效应 |
11.下列事实不能用勒沙特列原理解释的是( )
| A. | 氨水应密闭保存,放置低温处 | |
| B. | 在FeSO4溶液中,加入Fe粉以防止变质 | |
| C. | 生产硝酸的过程中使用过量空气以提高氨气的利用率 | |
| D. | 实验室常用排饱和食盐水的方法收集Cl2 |
15.下列化学用语正确的是( )
| A. | H2O2的电子式 | |
| B. | 甲醛的结构简式:CH2O | |
| C. | N2的结构式::N≡N: | |
| D. | 质子数为53、中子数为72的碘原子:${\;}_{53}^{125}$I |

 ,AB2中的化学键是共价键
,AB2中的化学键是共价键