题目内容
3.2015年初,雾霾天气多次肆虐我国中东部地区.其中汽车尾气是造成空气污染的主要原因.汽车尾气净化的主要原理为:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$2CO2(g)+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图1所示.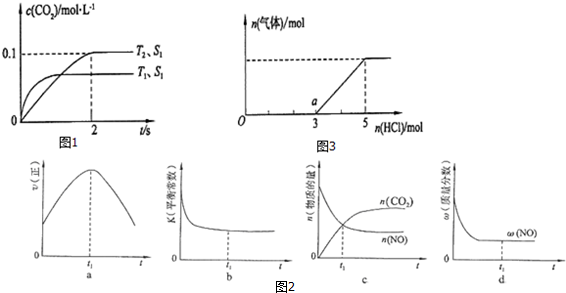
(1)该反应的△H< 0(选填“>’’、“<“).
(2)在T2温度下,0~2s内的平均反应速率v(N2)=0.025mol/(L•s)
(3)当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,在图1中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线.
(4)若该反应在绝热、恒容的密闭体系中进行,图2的示意图正确且能说明反应在进行到t1时刻达到平衡状态的是bd(填代号).
(5)将一定量的H2S气体通入0.05mol•L-1CuSO4溶液中,二者恰好完全反应.已知Ksp(CuS)=6.0×10-36.若不考虑溶液体积的变化,则:
①反应后溶液的pH=1.
②若反应后溶液中c(S2-)=2.0×10-30mol•L-1,则溶液中c(Cu2+)=3×10-6mol•L-1.
(6)将一定量的H2S气体通人NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,产生的气体与HCl的物质的量的关系如图3所示(忽略气体的溶解和HCl的挥发).
①O点溶液中所含溶质的化学式为Na2S和NaOH.
②已知a点溶液呈碱性,该溶液中离子的物质的量浓度由大到小的顺序是c(Na+)>c(Cl-)>c(HS-)>c(OH-)>c(H+)>c(S 2-).
分析 (1)由曲线斜率可知T1温度较高,升高温度c(CO2)减小,说明平衡逆向移动;
(2)在T2温度下,0~2s内c(CO2)增大到0.1mol/L,结合v=$\frac{△c}{△t}$计算,再根据速率之比等于化学计量数之比计算v(N2);
(3)催化剂不改变平衡状态,固体表面积越大,反应速率越大;
(4)达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变;
(5)①根据硫酸根离子守恒计算氢离子的浓度,再根据氢离子浓度计算溶液的pH;
②根据溶度积常数计算;
(6)Na2S+HCl=NaCl+NaHS、NaHS+HCl=NaCl+H2S↑,根据图象知,不生成气体需要酸的物质的量大于生成气体时需要酸的物质的量,说明溶液中还存在NaOH;
a点是溶液中的溶质是NaCl、NaHS,根据物料守恒、溶液酸碱性结合电荷守恒判断离子浓度大小.
解答 解:(1)由图1可知,温度T1先到达平衡,故温度T1>T2,温度越高平衡时,二氧化碳的浓度越低,说明升高温度平衡向逆反应移动,故正反应为放热反应,即△H<0,
故答案为:<;
(2)由图可知,T2温度时2s到达平衡,平衡时二氧化碳的浓度变化量为0.1mol/L,故v(CO2)=$\frac{0.1mol/L}{2s}$=0.05mol/(L•s),速率之比等于化学计量数之比,故v(N2)=$\frac{1}{2}$v(CO2)=$\frac{1}{2}$×0.05mol/(L•s)=0.025mol/(L•s),
故答案为:0.025mol/(L•s);
(3)接触面积越大反应速率越快,到达平衡的时间越短,催化剂的表面积S1>S2,S2条件下达到平衡所用时间更长,但催化剂不影响平衡移动,平衡时二氧化碳的浓度与温度T1到达平衡时相同,故c(CO2)在T1、S2条件下达到平衡过程中的变化曲线为: ,
,
故答案为: ;
;
(4)a、到达平衡后正、逆速率相等,不再变化,t1时刻V正最大,之后随反应进行速率发生变化,未到达平衡,故a错误;
b、该反应正反应为放热反应,随反应进行温度升高,化学平衡常数减小,到达平衡后,温度为定值,达最高,平衡常数不变,为最小,图象与实际符合,故b正确;
c、t1时刻后二氧化碳、CO的物质的量发生变化,t1时刻未到达平衡状态,故c错误;
d、NO的质量分数为定值,t1时刻处于平衡状态,故d正确,
故答案为:bd;
(5)①反应生活CuS和硫酸,根据硫酸根离子守恒得c(H+)=2c(SO42-)=0.1mol/L,所以溶液的pH=1,故答案为:1;
②溶液中c(Cu2+)=$\frac{6.0×1{0}^{-36}}{2.0×1{0}^{-30}}$mol/L=3×10-6mol/L,
故答案为:3×10-6;
(6)①Na2S+HCl=NaCl+NaHS、NaHS+HCl=NaCl+H2S↑,根据图象知,不生成气体需要酸的物质的量大于生成气体时需要酸的物质的量,说明溶液中除了含有Na2S外还存在NaOH;
故答案为:Na2S和NaOH;
②a点是溶液中的溶质是NaCl、NaHS,根据需要n(HCl)知,O点溶液中n(NaOH)=1mol、n(Na2S)=2mol,发生反应后a点n(NaCl)=3mol、n(NaHS)=2mol,HS-水解程度大于电离程度导致溶液呈碱性,则c(OH-)>c(H+),水和HS-都电离出氢离子,所以c(H+)>c(S 2-),根据物料守恒得c(Na+)>c(Cl-),弱离子的水解程度较小,所以溶液中离子浓度大小顺序是:c(Na+)>c(Cl-)>c(HS-)>c(OH-)>c(H+)>c(S 2-),
故答案为:c(Na+)>c(Cl-)>c(HS-)>c(OH-)>c(H+)>c(S 2-).
点评 本题考查较为综合,涉及化学平衡图象、化学反应速率、影响化学平衡的因素、离子浓度大小比较、难溶物的溶解平衡等知识点,根据溶度积常数、溶质的性质等知识点来分析解答,难点是离子浓度大小比较,题目综合性较大,难度中等,是对知识的综合利用、注意基础知识的理解掌握.

| A. | 非金属性:F>Cl>Br>I | B. | 单质氧化性:F2>Cl2>Br2>I2 | ||
| C. | 氢化物稳定性:HF>HCl>HBr>HI | D. | 沸点:F2>Cl2>Br2>I2 |
| A. | Mg 和 Ag | B. | Mg和 Al | C. | Cu和 Zn | D. | Fe 和 Zn |
| A. | 氨水应密闭保存,放置低温处 | |
| B. | 在FeSO4溶液中,加入Fe粉以防止变质 | |
| C. | 生产硝酸的过程中使用过量空气以提高氨气的利用率 | |
| D. | 实验室常用排饱和食盐水的方法收集Cl2 |
| A. | 大于零即可 | B. | 大于0.6mol | C. | 大于或等于1mol | D. | 任意值 |
| A. | H2O2的电子式 | |
| B. | 甲醛的结构简式:CH2O | |
| C. | N2的结构式::N≡N: | |
| D. | 质子数为53、中子数为72的碘原子:${\;}_{53}^{125}$I |
| A. | 0.1mol-NH2(氨基)中含有的电子数目为1.0NA | |
| B. | 常温下,1L 0.1mol•L-1 CH3COONa溶液中含有阴离子总数大于0.1NA | |
| C. | 标准状况下,2.24 LH2O中含有的原子总数大于0.3NA | |
| D. | 常温常压下,16 g O2和O3混合气体含有的氧原子数为NA |
| A. | 4种 | B. | 8种 | C. | 7种 | D. | 6种 |

 ,AB2中的化学键是共价键
,AB2中的化学键是共价键