题目内容
20.化学兴趣小组设计以下实验方案,测定某已部分变质小苏打样品中Na2CO3的质量分数.【方案一】称取一定质量样品,置于坩埚中加热至恒重后冷却,称量剩余固体质量,计算.
(1)实验中,需加热至恒重的目的是保证NaHCO3分解完全.
(2)坩埚中发生反应的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
【方案二】称取一定质量样品,置于小烧杯中,加适量水溶解;向小烧杯中加入足量Ba(OH)2溶液,过滤,洗涤、干燥沉淀,称量固体质量,计算.
(1)过滤操作中,除了烧杯、漏斗外,还要用到的玻璃仪器为玻璃棒.
(2)向混合液中(NaHCO3少量)中加足量Ba(OH)2溶液时的离子方程式为Ba2++HCO3-+OH-=BaCO3↓+H2O
【方案三】按如图所示装置进行实验:
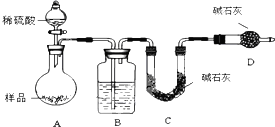
(1)B中盛放的试剂是浓硫酸D装置的作用是防止空气中的水蒸气、二氧化碳进入C装置.
(2)实验前称取17.90g样品,实验后测得C装置增重 8.80g,则样品中Na2CO3的质量分数为29.6%.(保留小数点后一位)
分析 [方案一]碳酸氢钠不稳定,受热易分解,根据加热前后固体质量变化,根据差量法求碳酸氢钠的质量,进而求得碳酸钠的质量分数.
(1)加热恒重保证碳酸氢钠完全分解;
(2)碳酸氢钠受热分解生成碳酸钠、水和二氧化碳;
[方案二]碳酸钠和碳酸氢钠都和氢氧化钡反应生成碳酸钡沉淀,根据生成沉淀的质量来计算碳酸钠的质量分数.
(1)根据过滤操作考虑所需仪器;
(2)向混合液(NaHCO3少量)中加足量Ba(OH)2溶液反应生成碳酸钡、氢氧化钠和水;
[方案三]由测定含量的实验可知,A中发生Na2CO3+H2SO4=H2O+CO2↑+Na2SO4、2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑,B中为浓硫酸吸收水,干燥二氧化碳,利用C装置吸收二氧化碳,D装置防止空气中的二氧化碳、水进入C装置干扰含量测定,结合反应计算含量,以此来解答.
解答 解:[方案一](1)实验原理是根据加热前后固体质量变化来计算碳酸氢钠,故应保证碳酸氢钠完全分解,加热恒重则碳酸氢钠完全分解,故答案为:保证NaHCO3分解完全;
(2)碳酸氢钠受热分解生成碳酸钠、水和二氧化碳,反应方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
[方案二](1)过滤时需用玻璃棒引流,故答案为:玻璃棒;
(2)向混合液(NaHCO3少量)中加足量Ba(OH)2溶液反应生成碳酸钡、氢氧化钠和水,反应离子方程式为:Ba2++HCO3-+OH-=BaCO3↓+H2O,
故答案为:Ba2++HCO3-+OH-=BaCO3↓+H2O;
[方案三](1)由测定含量的实验可知,A中发生Na2CO3+H2SO4=H2O+CO2↑+Na2SO4、2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑,B中为浓硫酸吸收水,干燥二氧化碳;
空气中的水蒸气和二氧化碳会被碱石灰吸收,故D的作用是吸收空气中的水蒸气和二氧化碳,以确保C装置中质量增加量的准确性;故答案为:浓硫酸;防止空气中的水蒸气、二氧化碳进入C装置;不能;
(2)设NaHCO3和Na2CO3的物质的量分别为x、y,则
Na2CO3+H2SO4=H2O+CO2↑+Na2SO4、
x x
2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑
y y
$\left\{\begin{array}{l}{106x+84y=17.90}\\{44x+44y=8.80}\end{array}\right.$,解得$\left\{\begin{array}{l}{x=0.05}\\{y=0.15}\end{array}\right.$,
则样品中Na2CO3的质量分数为$\frac{0.05mol×106g/mol}{17.90g}$×100%=29.6%,
故答案为:29.6%.
点评 本题考查碳酸钠含量的测定实验,为高频考点,把握实验装置的作用及实验目的为解答的关键,侧重分析、计算及实验能力的综合考查,题目难度中等.

| A. | Mg2+、Cl-、Na+、SO42- | B. | Ba2+、Na+、NO3-、MnO4- | ||
| C. | K+、Cl-、HCO3-、NO3- | D. | Ca2+、Na+、Fe3+、CO32 |
| A. | CO32- | B. | Ba2+ | C. | Ag+ | D. | Al3+ |
| A. | 3:1 | B. | 2:1 | C. | 1:1 | D. | 1:2 |
| A. | 含金属元素的离子不一定都是阳离子 | |
| B. | 金属阳离子被还原不一定得到金属单质 | |
| C. | 金属离子只能被还原,不能被氧化 | |
| D. | 金属氧化物不一定都是碱性氧化物 |
| A. | 我国流通的硬币材质是金属单质 | |
| B. | 所有的不锈钢都只含有金属元素 | |
| C. | 黄铜的熔点高于金属铜,故应用广泛 | |
| D. | 镁合金的硬度和机械强度均高于纯镁 |
| A. | 除去苯中苯酚,加入溴水后过滤 | |
| B. | 乙醛中含乙酸杂质,加入氢氧化钠溶液洗涤,分液 | |
| C. | 除去乙酸乙酯中乙酸,加入饱和NaOH溶液,振荡静置后分液 | |
| D. | 区别乙酸、乙醛、乙醇,加入新制的Cu(OH)2悬浊液加热 |

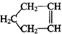 可简写为
可简写为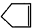 ,
,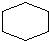 C6H12
C6H12 C7H10.
C7H10. 铁和铁的化合物用途广泛.请回答下列问题:
铁和铁的化合物用途广泛.请回答下列问题: