题目内容
10. 铁和铁的化合物用途广泛.请回答下列问题:
铁和铁的化合物用途广泛.请回答下列问题:(1)写出在潮湿空气中钢铁锈蚀时正极反应的电极反应式:O2+4e-+2H2O=4OH-
(2)爱迪生蓄电池的反应式为Fe+NiO2+2H2O$?_{充电}^{放电}$Fe(OH)2+Ni(OH)2
①放电时电极反应式为:负极Fe+2OH--2e-═Fe(OH)2;正极NiO2+2H2O+2e-═Ni(OH)2+2OH-.
②高铁酸钠(Na2FeO4)是一种新型净水剂.用如图装置可以制取少量高铁酸钠.写出在用电解法制取高铁酸钠时,阳极的电极反应式Fe-6e-+8OH-=FeO42-+4H2O.
分析 (1)潮湿的空气中,钢铁易发生吸氧腐蚀,正极上氧气得电子发生还原反应;
(2)①原电池放电时,铁为负极失电子发生氧化反应,正极得电子发生还原反应;
②电解氢氧化钠溶液时,铁作阳极,阳极上铁失电子和氢氧根离子反应生成高铁酸根离子;
解答 解:(1)钢铁在潮湿的空气中发生吸氧腐蚀,正极上氧气得电子和水反应生成氢氧根离子O2+4e-+2H2O=4OH-,故答案为:O2+4e-+2H2O=4OH-;
(2)①放电时,铁为负极失电子发生氧化反应,反应式为Fe+2OH--2e-═Fe(OH)2,镍元素的化合价由+4价变为+2价,所以NiO2作正极得电子发生还原反应,反应式为NiO2+2H2O+2e-═Ni(OH)2+2OH-,故答案为:Fe+2OH--2e-═Fe(OH)2;NiO2+2H2O+2e-═Ni(OH)2+2OH-;
②阳极上铁失电子和氢氧根离子反应生成高铁酸根离子和水,离子方程式为:Fe-6e-+8OH-=FeO42-+4H2O,故答案为:Fe-6e-+8OH-=FeO42-+4H2O;
点评 本题考查了原电池和电解池原理,根据各个电极上发生的反应来分析原电池和电解池,注意高铁酸钠作净水剂原理,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.下列有关实验操作或结果正确的是( )
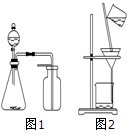

| A. | 选择合适试剂,用图1装置分别制取CO2、NO和O2 | |
| B. | 制备乙酸乙酯时,向乙醇中缓慢加入浓硫酸和冰醋酸 | |
| C. | 洗涤沉淀时(图2),向漏斗中加适量水,搅拌并滤干 | |
| D. | 用pH试纸测得0.10 mol•L-1NaF溶液的pH=5.2 |
18.常温下,在溶液中可发生以下反应:①16H++10Z-+2XO4-═2X2++5Z2+8H2O,②2M2++R2═2M3++2R-,③2R-+Z2═R2+2Z-,由此判断下列说法错误的是( )
| A. | 氧化性强弱顺序为:XO4-<Z2<R2<M3+ | |
| B. | 还原性强弱顺序为:X2+<Z-<R-<M2+ | |
| C. | Z元素在反应①中被氧化,在③中被还原 | |
| D. | 常温下可发生反应2M2++Z2═2M3++2Z- |
5.下列各组有机物中,只需加入溴水就能一一鉴别的是( )
| A. | 已烯、苯、四氯化碳 | B. | 苯、已炔、已烯 | ||
| C. | 已烷、苯、环已烷 | D. | 甲苯、已烷、已烯 |
15.现有A、B、C、D、E、F六种位于周期表前四周期元素,其原子序数依次增大,相关信息如表所示:
根据以上信息,回答下列问题:
(1)画出元素C的基态价电子排布图: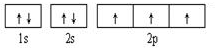 ;F元素位于周期表的d区;B、C、D三种元素的第一电离能由大到小顺序为:N>O>C(用元素符号表示).
;F元素位于周期表的d区;B、C、D三种元素的第一电离能由大到小顺序为:N>O>C(用元素符号表示).
(2)化合物BA2D2蒸气293K时,理论测算密度为2.0g•L-1,实际密度为2.5g•L-1的原因是甲酸形成分子间氢键.
(3)ED2中F原子的杂化类型为sp2; ED2易溶于水的原因可能是:①②(填入序号).
①ED2与水极性相同 ②ED2可以与水反应
(4)有人推测化合物CA5的存在,该化合物中含有化学键的可能类型为:离子键、共价键.
| 元素 | 性质 |
| A | 一种核素的原子核内不含中子 |
| B | 原子核外电子有6种不同运动状态 |
| C | 最高价氧化物的水化物与其氢化物可发生非氧化还原反应 |
| D | 单质之一为淡蓝色气体,可阻挡对人体有害的紫外线 |
| E | 周期表中位于短周期,基态原子M层成对电子数是未成对电子数的2倍 |
| F | 该元素的一种氧化物M可用作油漆颜料,与某单质反应可应用于焊接钢轨 |
(1)画出元素C的基态价电子排布图:
 ;F元素位于周期表的d区;B、C、D三种元素的第一电离能由大到小顺序为:N>O>C(用元素符号表示).
;F元素位于周期表的d区;B、C、D三种元素的第一电离能由大到小顺序为:N>O>C(用元素符号表示).(2)化合物BA2D2蒸气293K时,理论测算密度为2.0g•L-1,实际密度为2.5g•L-1的原因是甲酸形成分子间氢键.
(3)ED2中F原子的杂化类型为sp2; ED2易溶于水的原因可能是:①②(填入序号).
①ED2与水极性相同 ②ED2可以与水反应
(4)有人推测化合物CA5的存在,该化合物中含有化学键的可能类型为:离子键、共价键.
19.下列反应属于吸热反应的是( )
| A. | 酸碱中和反应 | B. | 氢气的燃烧 | ||
| C. | 锌与硫酸反应 | D. | 碳与二氧化碳反应 |
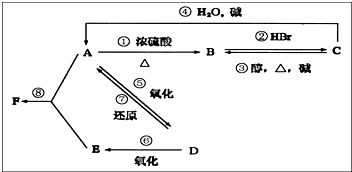 某有机物A,由C、H、O三种元素组成,在一定条件下,由A可以转化为有机物B、C和D、E;C又可以转化为B、A.它们的转化关系如图,已知D的蒸气密度是氢气的22倍,并可以发生银镜反应.
某有机物A,由C、H、O三种元素组成,在一定条件下,由A可以转化为有机物B、C和D、E;C又可以转化为B、A.它们的转化关系如图,已知D的蒸气密度是氢气的22倍,并可以发生银镜反应.