题目内容
15.已知H2、CH4的燃烧热分别为286KJ/mol、890KJ/mol实验测得氢气和甲烷的混和气体共1mol完全燃烧时放热588kJ,则混和气体中氢气与甲烷的体积比约为( )| A. | 3:1 | B. | 2:1 | C. | 1:1 | D. | 1:2 |
分析 物质燃烧放出的热量和可燃物的物质的量之间成正比,设出H2的物质的量为n,则CH4的物质的量为1mol-n,根据H2、CH4的燃烧热,利用方程式和混和气体共1mol完全燃烧时放热588kJ,来解各自的物质的量即可得出结果.
解答 解:H2、CH4的燃烧热分别为286KJ/mol、890KJ/mol,则H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-286kJ/mol;CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890kJ/mol,
设混合气中H2的物质的量为n,则CH4的物质的量为1mol-n.根据题意,列方程为:286kJ/mol×n+890.0kJ/mol×(1mol-n)=588kJ,解得 n=0.5mol;CH4的物质的量为1mol-0.5mol=0.5mol,
所以混合气体中H2与C3H8的体积比即物质的量之比0.5 mol:0.5 mol=1:1,
故选C.
点评 本题考查了反应热的计算,注意热化学方程式对应焓变的计算方法,题目难度不大.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
5.下列反应的能量变化属于吸热反应的是( )
| A. | 氢氧化钠溶液与盐酸反应 | B. | Ba(OH)2•8H2O与NH4Cl反应 | ||
| C. | 铝片与盐酸反应 | D. | 钠与冷水反应 |
6.以苯为原料,不能通过一步反应制得的有机物是( )
| A. | 氯苯 | B. | 硝基苯 | C. | 环己烷 | D. | 苯酚 |
3.下列各组离子,能大量共存于同一溶液中的是( )
| A. | Na+、Cl-、Mg2+、SO42- | B. | H+、K+、NO3-、CO32-、 | ||
| C. | Ag+、NO3-、Cl -、Cu2+ | D. | Ba2+、Na+、NO3-、SO42- |
10.关于硅及其化合物的叙述错误的是( )
| A. | SiO2是生产粗硅的主要原料 | |
| B. | 晶体硅(Si)是生产光缆和光导纤维的主要原料 | |
| C. | 水泥、玻璃、陶瓷的主要成份都是硅酸盐 | |
| D. | 盛放氢氧化钠溶液的玻璃试剂瓶不能用磨口玻璃塞 |
4.由NO、H2、CO2组成的混合气体,通过足量的Na2O2充分反应后,再用电火花引燃使其充分反应后,最终只得到质量分数为70%的硝酸,无其他气体剩余.则原混合气体中NO、H2、CO2的体积比( )
| A. | 2:4:7 | B. | 2:4:5 | C. | 2:4:3 | D. | 3:5:8 |
5.下列各组有机物中,只需加入溴水就能一一鉴别的是( )
| A. | 已烯、苯、四氯化碳 | B. | 苯、已炔、已烯 | ||
| C. | 已烷、苯、环已烷 | D. | 甲苯、已烷、已烯 |
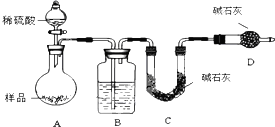
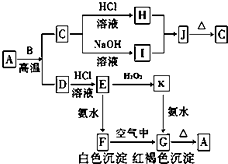 A是一种红棕色金属氧化物,B、D是常见金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解.
A是一种红棕色金属氧化物,B、D是常见金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解.