题目内容
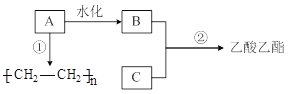
【题目】已知B是酒的主要成分、C是食醋的主要成分。下图是相关有机物的转换关系:
完成下列填空。
(1)A的结构简式为______,工业上生产A所需的矿物资源是______。
(2)请写出C的官能团名称___________。
(3)反应②的化学方程式为_____________。
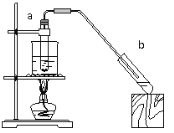
(4)实验室用如图装置制取乙酸乙酯。实验时需预先在用于收集乙酸乙酯的试管b中加入_____溶液。实验结束后,发现试管b中的液体分两层,乙酸乙酯在____层(填“上”或“下”),分离乙酸乙酯的实验操作方法是_______。
【答案】CH2=CH2 石油 羧基 CH3COOH+CH3CH2OH ![]() CH3COOCH2CH3+H2O 饱和碳酸钠 上 分液
CH3COOCH2CH3+H2O 饱和碳酸钠 上 分液
【解析】
B是酒的主要成分、C是食醋的主要成分,则B为CH3CH2OH、C为CH3COOH,B与C反应生成CH3COOC2H5,A水化得到乙醇,则A为 CH2=CH2;
(1)A为乙烯,乙烯是衡量石油化工发展水平的标志;
(2)C为乙酸;
(3)反应②是乙酸乙醇在浓硫酸催化作用下生成乙酸乙酯;
(4)为了除去乙酸乙酯中的杂质,一般把乙酸乙酯蒸汽通入饱和碳酸钠溶液;乙酸乙酯的密度比水小;
B是酒的主要成分、C是食醋的主要成分,则B为CH3CH2OH、C为 CH3COOH,B与C反应生成CH3COOC2H5,A水化得到乙醇,则A为 CH2=CH2;
(1)A为乙烯,其结构简式为CH2=CH2,工业上生产乙烯主要是通过对石油分馏产品的裂解得到;
(2)C为乙酸,含有的官能团为羧基;
(3)反应②是乙酸乙醇在浓硫酸催化作用下生成乙酸乙酯,其反应方程式为CH3COOH+CH3CH2OH ![]() CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;
(4)为了除去乙酸乙酯中的杂质乙酸和乙醇,一般要把乙酸乙酯蒸汽通入饱和碳酸钠溶液中;乙酸乙酯的密度比水小,则乙酸乙酯在上层,水溶液在下层;分离互不相溶的液体混合物应选择分液操作。

 轻松暑假总复习系列答案
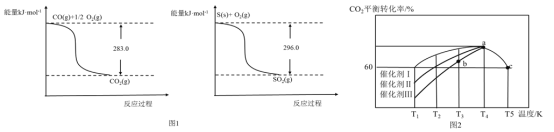
轻松暑假总复习系列答案【题目】700℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1):
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是
A. 反应在t1 min内的平均速率为v(H2)=![]() mol·L-1·min-1
mol·L-1·min-1
B. 保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.40mol
C. 保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率不变,H2O的体积分数不变
D. 温度升高至800 ℃,上述反应平衡常数为0.64,则正反应为放热反应
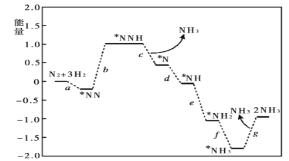
【题目】2013年9月,中国华北华中地区发生了严重的雾霾天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染。汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霾形成的原因。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) △H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1 时刻达到平衡状态。
N2(g)+2CO2(g) △H<0,在一定温度下,在一体积固定的密闭容器中充入一定量的NO和CO在t1 时刻达到平衡状态。
①能判断该反应达到平衡状态的标志是____________________。
A.在单位时间内生成1mol CO2的同时消耗了1mol CO B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变 D.混合气体的压强不再变化
②在t2时刻,将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态,之后不再改变条件。请在右图中补充画出从t2 到t4 时刻正反应速率随时间的变化曲线:_____________

(2)改变煤的利用方式可减少环境污染,通常可将水蒸气通过红热的碳得到水煤气,1.2g 碳完全反应,吸收热量13.13kJ.
①该反应的热化学方程式为______________________________________________
②煤气化过程中产生的有害气体H2S可用足量的Na2C03溶液吸收,该反应的离子方程式为___________________________________________________。(已知:H2S: ![]() ;
; ![]() ;H2CO3:
;H2CO3: ![]() ;
; ![]() )
)
(3)已知反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
CO2(g)+H2(g),现将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行反应,得到如下三组数据:
实验 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | ||
CO | H2O | H2 | CO | 0 | ||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1条件下平衡常数K=______________(保留小数点后二位)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是__________。
③该反应的△H ______0(填“<”或“>”);若在900℃时,另做一组实验,在此容器中加入l0mol CO,5mo1 H2O,2mo1 CO2,5mol H2,则此时v正___________v逆(填“<”,“>”,“=”)。