题目内容
【题目】A、B、C、D、E为原子序数依次增大的五种前四周期元素。A的核外电子总数与其周期数相同;B的价电子排布式为nsnnpn+2;短周期元素C和D为同周期不相邻的元素,C是同周期元素中离子半径最小的元素,D元素最外层有两个未成对电子;E位于元素周期表的第四周期第IVB族,常用加热ECl4(氯化物)溶液的方法制备纳米材料。回答下列问题:
(1)D元素在周期表中的位置为______,E原子核外有_____个未成对电子,五种元素中电负性最大的是_____(填元素名称)。
(2)由A、B、D三种元素形成的常见三元化合物中具有强氧化性的是______(填化学式)。
(3)氯元素能与C(非碳元素符号)形成某化合物Q。在1.01×105Pa、T1℃时,气体摩尔体积为53.4L/mol,实验测得Q的气态密度为5.00g/L,则此时Q的结构式为___________。(如有配位键须用“→”标出)
(4)A、B、D元素形成的化合物有A2B、DB3,下列关于A2B和DB3的说法中,正确的是________(填标号)。
A.中心原子的价层电子对数目相等 B.都是非极性分子
C.中心原子的孤电子对数目相等 D.都含有极性键
E.都能与Na2O反应 F.固态时晶体类型不同
(5)D在空气中燃烧的产物分子构型为_________。固体DB3中存在如图所示的三聚分子,该分子中D原子的杂化轨道类型为________。

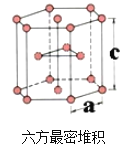
(6)E单质有两种同素异形体,高温下是体心立方堆积;但在常温下的晶体结构为如下图所示的六方最密堆积(底面是正六边形)。已知常温下晶体晶胞参数分别为a cm和c cm,则该晶体的密度可表示为________g·cm-3。(用含a和c的式子表示,用NA表示阿伏伽德罗常数的值)。
【答案】第三周期第VIA族 2 氧 H2SO4 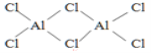 D E V形 sp3
D E V形 sp3 ![]()
【解析】
A、B、C、D、E为原子序数依次增大的五种前四周期元素。B的价电子排布式为nsnnpn+2,n=2则为2s22p4,即B为O元素;A的核外电子总数与其周期数相同且原子序数小于B,则A为H元素;短周期元素C和D为同周期,应为第三周期,C是同周期元素中离子半径最小的元素,则为Al元素,D元素最外层有两个未成对电子,则为S元素;E位于元素周期表的第四周期第IVB族,常用加热ECl4(氯化物)溶液的方法制备纳米材料,则E为Ti元素。
(1)D为S元素,在周期表中的位置为第三周期第VIA族,E为Ti元素,基态原子电子排布式为[Ar]3d24s2,原子核外有2个未成对电子,元素非金属性越强电负性越大,则五种元素中电负性最大的是氧(注意填名称);
(2)由A、B、D三种元素形成的常见三元化合物可以是H2SO3、H2SO4等,具有强氧化性的是H2SO4;
(3)氯元素能与C(非碳元素符号)形成某化合物Q,根据铝和氯的化合价可设Q为(AlCl3)n,在1.01×105Pa、T1℃时,气体摩尔体积为53.4L/mol,实验测得Q的气态密度为5.00g/L,则M=ρVm=5.00g/L×53.4L/mol=267g/mol,则133.5n=267,解得n=2,此时Q的化学式为Al2Cl6,则此时Q的结构式为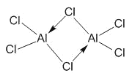 ;
;
(4)A、B、D元素形成的化合物有A2B、DB3分别是H2O、SO3。
A.H2O中O价层电子对数=2+1/2(6-2×1)=4,而SO3中S价层电子对数=3+1/2(6-3×2)=3,因而中心原子的夹层电子对数目不相等,A错误;
B.水分子为非极性分子,而三氧化硫分子为极性分子,B错误;
C.水分子中O原子有2个孤电子对,三氧化硫分子中S原子不存在孤对电子,C错误;
D.极性键指不同原子间形成的共价键,H2O中含两个氧氢键,SO3中含硫氧键,均为极性键,D正确;
E.H2O与Na2O反应得到NaOH,而SO3和Na2O反应得到Na2SO4,E正确;
F.由于H2O和SO3均为分子,固体时晶体类型同为分子晶体,F错误。
故答案选DE。
(5)D在空气中燃烧的产物分子式SO2,S原子最外层6e-,考虑杂化时O原子不提供电子,故6/2=3应该是sp2杂化,又S原子只连有2个原子,故为V形分子(折线形),固体SO3如图所示,S原子为为边缘颜色较深的小球,其与四个O原子连接,根据空间构型与杂化的关系可知,S原子采取sp3杂化。
(6)如图所示,底边正六边形面积=6×![]() ×
×![]() ×acm2,则晶胞体积V=
×acm2,则晶胞体积V=![]() a2c cm3,Ti的摩尔质量为48g/mol,上下底边顶点Ti原子一个晶胞占有
a2c cm3,Ti的摩尔质量为48g/mol,上下底边顶点Ti原子一个晶胞占有![]() ,共有12×
,共有12×![]() =2,上下底边面上中心Ti原子一个晶胞占有
=2,上下底边面上中心Ti原子一个晶胞占有![]() ,共有2×
,共有2×![]() =1,晶胞内有3个Ti,为晶胞所完全占有,因而晶胞内共有2+1+3=6个Ti原子,因而晶胞Ti质量m=
=1,晶胞内有3个Ti,为晶胞所完全占有,因而晶胞内共有2+1+3=6个Ti原子,因而晶胞Ti质量m=![]() g,密度=
g,密度=![]() =
=![]() g/cm3。
g/cm3。

 名校通行证有效作业系列答案
名校通行证有效作业系列答案