题目内容
【题目】(1)Co(NH3)5BrSO4可形成两种钴的配合物,已知两种配合物的分子式分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br,分别向两种配合物的溶液中加BaCl2溶液,有白色沉淀产生的是_____。
(2)向CuSO4溶液中逐滴加入稀氨水,所得配合物的化学式为_____,该配合物中存在的化学键类型为_________。
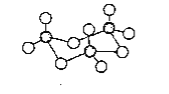
(3)铁可形成多种配位化合物,但与氨形成的化合物不稳定,如FeCl2虽然可以与氨气形[Fe(NH3)6]Cl2,但此物质遇水即生成灰白色沉淀,写出对应的反应方程式:_____。[Fe(H2O)6]2+与NO反应生成的[Fe(NO)(H2O)5]2+中,NO以N原子与Fe2+形成配位键。请在[Fe(NO)(H2O)5]2+结构示意图的相应位置补填缺少的配体_____。

【答案】[Co(NH3)5Br]SO4 [Cu(NH3)4]SO4 配位键、共价键(离子键) [Fe(NH3)6]Cl2+6H2O=Fe(OH)2+2NH4Cl+4NH3﹒H2O 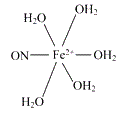
【解析】
(1)由[Co(NH3)5Br]SO4可知,硫酸根离子为配合物的外界,在水溶液中以离子形式存在,[Co(SO4)(NH3)5]Br中硫酸根离子为內界,在水溶液里不能以离子存在;(2)向CuSO4溶液中逐滴加入氨水,生成氢氧化铜沉淀,反应的离子方程式为Cu2++2NH3.H2O=Cu(OH)2+2NH4+,再加氨水可形成铜氨配合物[Cu(NH3)4]SO4;
(3)[Fe(NH3)6]Cl2遇水即生成灰白色沉淀为氢氧化亚铁;根据化学式可知缺少的配体为NO和H2O,NO中N为配位原子,H2O中氧原子为配位原子;
(1)由[Co(NH3)5Br]SO4可知,硫酸根离子为配合物的外界,在水溶液中以离子形式存在,所以会与钡离子结合成白色沉淀,[Co(SO4)(NH3)5]Br中硫酸根离子为內界,在水溶液里不能以离子存在,所以加入BaCl2溶液时无明显现象;
答案:[Co(NH3)5Br]SO4
(2)向CuSO4溶液中逐滴加入氨水,生成氢氧化铜沉淀,反应的离子方程式为Cu2++2NH3.H2O=Cu(OH)2+2NH4+,再加氨水可形成铜氨配合物[Cu(NH3)4]SO4,该配合物中存在的化学键类型为配位键、共价键(离子键);
答案:[Cu(NH3)4]SO4 配位键、共价键(离子键)
(3)[Fe(NH3)6]Cl2遇水即生成灰白色沉淀为氢氧化亚铁,方程式为[Fe(NH3)6]Cl2+6H2O=Fe(OH)2+2NH4Cl+4NH3﹒H2O;根据化学式可知缺少的配体为NO和H2O,NO中N为配位原子,H2O中氧原子为配位原子;
答案:[Fe(NH3)6]Cl2+6H2O=Fe(OH)2+2NH4Cl+4NH3﹒H2O 

 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案【题目】高炉炼铁过程中发生的主要反应为:![]() Fe2O3(s) + CO(g)
Fe2O3(s) + CO(g) ![]()
![]() Fe(s) + CO2(g)。已知该反应在不同温度下的平衡常数如下:
Fe(s) + CO2(g)。已知该反应在不同温度下的平衡常数如下:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
请回答下列问题:
(1)该反应的平衡常数表达式K=_____________,△H________0(填“>”、“<”或“=”)。
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe2O3、CO各1.0 mol,反应经过l0 min后达到平衡。求该时间范围内反应的平均反应速率υ(CO2)=______________________、CO的平衡转化率= _____________。
(3)欲提高(2)中CO的平衡转化率,可采取的措施是_____________。
A.减少Fe的量 B.增加Fe2O3的量 C.移出部分CO2
D.提高反应温度 E.减小容器的容积 F.加入合适的催化剂
(4)在1L的密闭容器中,1300℃条件,下列达平衡状态的是_______________。
A | B | C | D | |
n(Fe2O3) | 0.350 | 0.027 | 0.080 | 0.080 |
n(CO) | 0.010 | 0.010 | 0.010 | 0.050 |
n(Fe) | 0.100 | 0.064 | 0.080 | 0.080 |
n(CO2) | 0.035 | 0.088 | 0.040 | 0.050 |
.