题目内容
【题目】下列叙述中正确的是( )
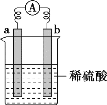
A.由铜、锌作电极与硫酸溶液组成的原电池中,溶液中的H+向正极移动
B.钢铁发生腐蚀时,正极上发生的反应为Fe-2e-=Fe2+
C.铜锌原电池工作时,若有13 g锌被溶解,溶液中就有0.4 mol电子通过
D.原电池必须有两个活泼性不同的金属作电极
【答案】A
【解析】
A.在原电池中,阳离子移向正极,A项正确;
B.钢铁发生腐蚀的实质是铁失去电子被氧化的过程,根据原电池原理,负极发生氧化反应,电极反应方程式为:Fe-2e-=Fe2+;B项错误;
C.铜锌原电池中,锌极作负极,发生氧化反应,电极反应方程式为:Zn-2e-=Zn2+,由反应方程式可知,每消耗1molZn,则转移2mole-。13gZn的物质的量为![]() , 则原电池中转移0.4 mol电子,电子通过导线从负极流向正极,C项错误;
, 则原电池中转移0.4 mol电子,电子通过导线从负极流向正极,C项错误;
D.原电池的电极可以是两种活动性不同的金属,也可以是一种金属和一种非金属导体作电极,D项错误;
答案选A。

练习册系列答案
相关题目