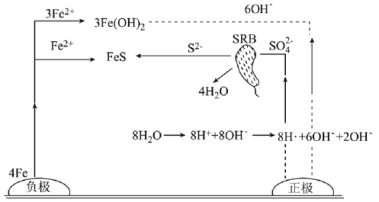
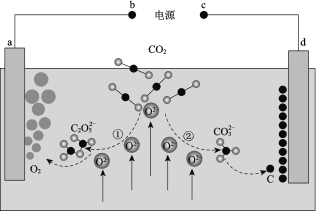
题目内容
【题目】已知水在25℃和95℃时,其电离平衡曲线如图所示:
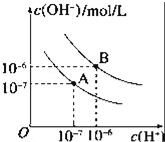
(1)95℃时水的电离平衡曲线应为___(填“A”或“B”).此温度下水的离子积KW=_____.
(2)95℃时,0.01mol/LNaOH溶液的pH=_____.
(3)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为______.
(4)曲线B对应温度下,pH=2的某HA溶液中,由水电离出的氢离子浓度为_____mol/L.
(5)若在水中加入少量MgCl2固体,则对水的电离有______作用。(填“促进”或“抑制”)
【答案】B 1.0×1012 10 10:1 10-10 促进
【解析】
(1) 95℃时水的电离产生的氢离子和氢氧根离子的浓度相等,所以两者浓度都为10-6mol/L; 横轴是氢离子浓度,纵轴是氢氧根离子浓度,由水的离子积常数Kw=c(H+)×c(OH-)计算出曲线的Kw值;
(2) 根据水的离子积常数Kw=c(H+)×c(OH-)计算,据此解答;
(3) 根据溶液的pH计算出溶液中氢离子、氢氧根离子浓度,再列式计算出氢氧化钠溶液和硫酸溶液的体积,据此解答;
(4) 曲线B对应温度下,Kw=c(H+)c(OH)=1012,据此解答;
(5)加入消耗水电离出来的氢离子或氢氧根离子的物质,促进水电离,据此解答。
(1) 95℃时水的电离产生的氢离子和氢氧根离子的浓度相等,所以两者浓度都为106mol/L,水的电离是吸热过程,温度升高电离程度增大, c (H+)、c(OH)均增大,故为曲线B;曲线B条件下c(H+)=c(OH)=106mol/L,Kw=c(H+)c(OH)=1012, 故答案为:B;1.0×1012;
(2)95℃时,0.01mol/LNaOH溶液中氢氧根离子的浓度为0.01mol/L,所以溶液中氢离子的浓度为:1010mol/L,所以溶液的pH=10,故答案为:10;
(3) n(OH)=n(H+),则V(NaOH) ·105mol·L1=V(H2SO4) ·104 mol·L1,得V(NaOH):V(H2SO4)=10:1,故答案为:10:1;
(4) 曲线B对应温度下,Kw=c(H+)c(OH)=1012,pH=2的某HA溶液中c(H+)=10-2 mol/L,由水电离出的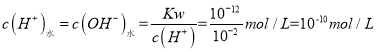 ,故答案为:10-10;
,故答案为:10-10;
(5) 若在水中加入少量MgCl2固体,镁离子会结合水电离出来的氢氧根,促进水电离,故答案为:促进。

【题目】甲醇既是基本有机化工原料,又可作为燃料用于替代矿物燃料。
(1)工业上合成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) ΔH。下表所列数据是该反应在不同温度下的化学平衡常数(K)。
CH3OH(g) ΔH。下表所列数据是该反应在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
平衡常数K | 2.041 | 0.270 | 0.012 |
由表中数据判断该反应为 ________反应(填“吸热”或“放热”)。 某温度下,将2 molCO和6 molH2充入2 L的密闭容器中充分反应,达到平衡后,测得c(CO)=0.2 mol/L,则CO的转化率为______,此时的温度为______(从表中选择)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH2kJ/mol
③H2O(g)=H2O(l) ΔH3kJ/mol
则反应CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH= _____________ kJ/mol(用ΔH1、ΔH2、ΔH3表示)。
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O72)时,实验室利用如图装置模拟该法:
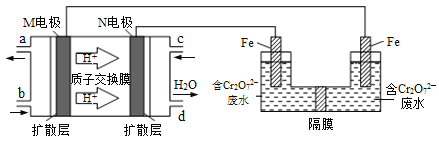
①N电极的电极反应式为 ___________________________________。
②请完成电解池中Cr2O72转化为Cr3+的离子反应方程式:
Cr2O72 + ______ Fe2+ + ______ = ______ Cr3+ + ______ Fe3+ + ______
(4)处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×105 mol/L时,Cr3+沉淀完全,此时溶液的pH=______。(已知:Ksp=6.4×1031,lg2=0.3)