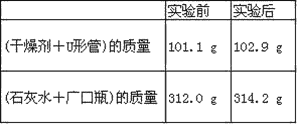
题目内容
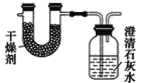
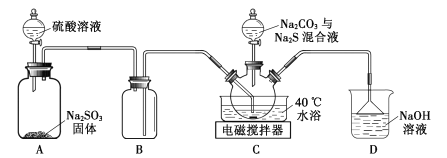
【题目】实验室用如图装置(略去夹持仪器)制取硫代硫酸钠晶体。
已知:①Na2S2O3.5H2O是无色晶体,易溶于水,难溶于乙醇。
②硫化钠易水解产生有毒气体。
③装置C中反应如下:Na2CO3+SO2=Na2SO3+CO2;2Na2S+3SO2=3S+2Na2SO3;S+Na2SO3![]() Na2S2O3。
Na2S2O3。
回答下列问题:
(1)装置B的作用是___。
(2)该实验能否用NaOH代替Na2CO3?___(填“能”或“否”)。
(3)配制混合液时,先溶解Na2CO3,后加入Na2S·9H2O,原因是___。
(4)装置C中加热温度不宜高于40℃,其理由是___。
(5)反应后的混合液经过滤、浓缩,再加入乙醇,冷却析出晶体。乙醇的作用是___。
(6)实验中加入m1gNa2S·9H2O和按化学计量的碳酸钠,最终得到m2gNa2S2O3·5H2O晶体。Na2S2O3·5H2O的产率为___(列出计算表达式)。[Mr(Na2S·9H2O)=240,Mr(Na2S2O3·5H2O)=248]
(7)下列措施不能减少副产物Na2SO4产生的是___(填标号)。
A.用煮沸并迅速冷却后的蒸馏水配制相关溶液
B.装置A增加一导管,实验前通人N2片刻
C.先往装置A中滴加硫酸,片刻后往三颈烧瓶中滴加混合液
D.将装置D改为装有碱石灰的干燥管
【答案】安全瓶,防止倒吸 能 碳酸钠溶液显碱性,可以抑制Na2S水解 温度过高不利于SO2的吸收,或消耗的H2SO4、Na2SO3较多,或Na2S2O3产率降低等其它合理答案 降低Na2S2O3晶体的溶解度,促进晶体析出 ![]() ×100% D
×100% D
【解析】
(1)装置B的作用是平衡压强,防止倒吸;
(2)Na2CO3的作用是与二氧化硫反应制备亚硫酸钠;
(3)Na2S是强碱弱酸盐,易发生水解;
(4)温度过高不利于二氧化硫的吸收,产品产率会降低;
(5) Na2S2O3.5H2O是无色晶体,易溶于水,难溶于乙醇;
(6)根据反应Na2CO3+SO2=Na2SO3+CO2;2Na2S+3SO2=3S+2Na2SO3;S+Na2SO3![]() Na2S2O3, 列关系式2Na2S·9H2O~3S~3Na2S2O3·5H2O,结合数据计算理论上制得Na2S2O3·5H2O晶体的质量,Na2S2O3·5H2O的产率为
Na2S2O3, 列关系式2Na2S·9H2O~3S~3Na2S2O3·5H2O,结合数据计算理论上制得Na2S2O3·5H2O晶体的质量,Na2S2O3·5H2O的产率为![]() ;
;
(7)Na2SO3易被氧化为硫酸钠,减少副产物的含量就要防止Na2SO3被氧化。
(1)装置B的作用是平衡压强,防止倒吸,则B为安全瓶防止倒吸;
(2)Na2CO3的作用是与二氧化硫反应制备亚硫酸钠,氢氧化钠和二氧化硫反应也可以生成亚硫酸钠,可以代替碳酸钠;
(3)Na2S是强碱弱酸盐,易发生水解,碳酸钠溶液显碱性,可以抑制Na2S水解;
(4) 温度过高不利于SO2的吸收,或消耗的H2SO4、Na2SO3较多,或Na2S2O3产率降低等其它合理答案;
(5) Na2S2O3.5H2O是无色晶体,易溶于水,难溶于乙醇,则乙醇的作用为:降低Na2S2O3晶体的溶解度,促进晶体析出;
(6)根据反应Na2CO3+SO2=Na2SO3+CO2;2Na2S+3SO2=3S+2Na2SO3;S+Na2SO3![]() Na2S2O3, 列关系式2Na2S·9H2O~3S~3Na2S2O3·5H2O,理论上制得Na2S2O3·5H2O晶体的质量为
Na2S2O3, 列关系式2Na2S·9H2O~3S~3Na2S2O3·5H2O,理论上制得Na2S2O3·5H2O晶体的质量为![]() g,Na2S2O3·5H2O的产率为
g,Na2S2O3·5H2O的产率为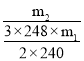 ×100%=
×100%=![]() ×100%;
×100%;
(7)A.用煮沸并迅速冷却后的蒸馏水中含氧量降低,可有效防止Na2SO3被氧化为Na2SO4,可减少副产物的产生,故A不符合题意;
B.装置A增加一导管,实验前通人N2片刻,可将装置中的空气赶走提供无氧环境,可防止Na2SO3被氧化为Na2SO4,可减少副产物的产生,故B不符合题意;
C.先往装置A中滴加硫酸,产生二氧化硫,可将装置中的空气赶走,片刻后往三颈烧瓶中滴加混合液,可减少副产物的产生,故C不符合题意;
D.将装置D改为装有碱石灰的干燥管,装置中仍然含有空气,氧气可将Na2SO3被氧化为Na2SO4,不能减少副产物产生,故D符合题意;
答案选D。