题目内容
【题目】2015年发生的天津港有关仓库物品爆炸涉及电石与氰化钠等,而CN-作为配位剂可形成[Au(CN)2]-、[Ag(CN)2]-、[Zn(CN)4]2-、[Fe(CN)3]4-、[Fe(CN)4]3-等。常把原子个数相同,最外层电子数也相同的微粒称作等电子体,同时它们的结构相似。
试分析并回答:
(1)电石的主要成分是__________(写化学式),其中阴离子与CN-是等电子体,写出CN-的电子式:__________。
(2)有着“闪电式死亡”之称的剧毒物品氰化钠,在地面水中很不稳定,pH大于7时,可被氧气氧化成碳酸盐和氨气,试写出该反应的离子方程式:______。
(3)以剧毒物氰化钠比例,从反应原理角度去思考如何防止其污染。试提出两个有关应用的好方案________、_______。
(4)电石中还含有CaS等,与水反应还有H2S的生成,H2S完全氧化生成S2,S2又可催化氧化生成SO3。已知2SO2(g)+O2(g)![]() 2SO3(g) △H<0。某温度下,将2mol SO2和1 mol O2置于10L密闭容器中,反应达到平衡后,SO2的平衡转化率(a)与体系总压强(p)的关系如图所示。
2SO3(g) △H<0。某温度下,将2mol SO2和1 mol O2置于10L密闭容器中,反应达到平衡后,SO2的平衡转化率(a)与体系总压强(p)的关系如图所示。
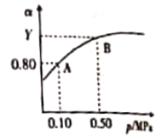
则①Y大于0.8的原因是__________;
②K(A)____________(填“大于”“等于”或“小于”)K(B);
③若压强为0.10MPa,试做出T1、T2不同温度下(设T2< T1)SO2转化率与温度的关系图__________。

【答案】CaC2 ![]()
![]() 方案一:湿法冶金; 方案二:含氰废水制备亚铁氰化钾(也可以用有关盐处理,使其转化为含氰配合物) 该反应是气体体积缩小的反应,温度一定时,增大压强,平衡向正反应方向移动,二氧化硫的转化率增大 等于
方案一:湿法冶金; 方案二:含氰废水制备亚铁氰化钾(也可以用有关盐处理,使其转化为含氰配合物) 该反应是气体体积缩小的反应,温度一定时,增大压强,平衡向正反应方向移动,二氧化硫的转化率增大 等于 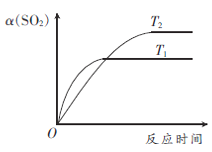
【解析】
(1)电石主要为碳化钙;根据碳化钙的结构推出CN-的电子式;
(2)根据题意结合氧化还原反应的规律书写离子方程式;
(3)结合氰化物的工业用法设计方案;
(4)2SO2(g)+O2(g)![]() 2SO3(g)为气体体积缩小的放热反应,结合外因对化学反应速率与化学平衡的影响效果回答;
2SO3(g)为气体体积缩小的放热反应,结合外因对化学反应速率与化学平衡的影响效果回答;
(1)电石主要成分的化学式为:CaC2,其阴离子中C与C原子共用3个电子对,因等电子体的结构相似,故CN-的电子式为:![]() ,故答案为:CaC2;
,故答案为:CaC2;![]() ;
;
(2)氰化钠中C为+2价,N为-3价,在碱性条件下可被氧气氧化成磷酸钠和氨气,根据氧化还原反应的规律可知,反应的离子方程式为:![]() ;
;
(3)根据题意可设计如下:
方案一:用湿法冶金氰化法提炼,即采用稀的NaCN溶液处理已粉碎的矿石,同时通入空气,把少量的金浸取到溶液中生成Na[Au(CN)2];
方案二:含氰废水制备亚铁氰化钾(也可以用有关盐处理,使其转化为含氰配合物),故答案为:方案一:湿法冶金;方案二:含氰废水制备亚铁氰化钾(也可以用有关盐处理,使其转化为含氰配合物);
(4)①该反应是气体体积缩小的反应,温度一定时,增大压强,平衡向正反应方向移动,二氧化硫的转化率增大,因此Y大于0.8,故答案为:该反应是气体体积缩小的反应,温度一定时,增大压强,平衡向正反应方向移动,二氧化硫的转化率增大;
②温度一定时,K值不变,因此K(A)等于K(B),故答案为:等于;
③2SO2(g)+O2(g)![]() 2SO3(g) △H<0,则压强一定时,升高温度,反应速率均增大,因T2< T1,根据“先拐先平数值大”的原则可知在T1条件先达到平衡状态;反应放热,升高温度不利于SO2的转化率,T2< T1,故达到平衡时,T2条件下SO2的转化率较高,综上SO2转化率与温度的关系图如下:
2SO3(g) △H<0,则压强一定时,升高温度,反应速率均增大,因T2< T1,根据“先拐先平数值大”的原则可知在T1条件先达到平衡状态;反应放热,升高温度不利于SO2的转化率,T2< T1,故达到平衡时,T2条件下SO2的转化率较高,综上SO2转化率与温度的关系图如下:
 。
。

 阅读快车系列答案
阅读快车系列答案【题目】N2O5是一种新型硝化剂,其性质和制备受到人们的关注。已知N2O5能与水发生反应,并放出大量的热。
Ⅰ.一定温度下,在恒容密闭容器中N2O5发生下列反应:2N2O5(g)![]() 4NO2(g)+O2(g)ΔH。
4NO2(g)+O2(g)ΔH。
(1)下表为反应在T1温度下的部分实验数据:
t/s | 0 | 500 | 1000 |
c(N2O5)/mol·L—1 | 5.00 | 3.52 | 2.48 |
则500s内NO2的生成速率为______________。
(2)反应达到平衡后,若再通入一定量N2O5,达到新平衡时,N2O5的转化率将______(填“增大”、“减小”、“不变”)。
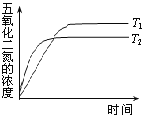
(3)在温度T1和T2时,N2O5的浓度与反应时间的关系如图所示。据此判断:T1______T2(填“>”、“<”或“=”,下同),ΔH______0。
Ⅱ.下图所示装置,可用于制备N2O5气体。A是电源的____________(填“负极”或“正极”),电解池的阳极反应式为______________________________________________________。
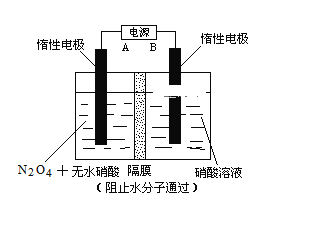
【题目】NF3(三氟化氮)在常温常压下是无色、无味的气体,是微电子工业中一种优良的等离子蚀刻气体。回答下列问题:
(1)NF3的电子式为______,N元素的化合价为______。
(2)F2与NH3直接反应生成NF3的化学方程式为______。
(3)实验室模拟工业上利用电解熔融NH4HF2(NH4FHF)法制取NF3,阳极为以Ni为基本材料的合金(内含其他金属,忽略镍及其他金属的反应),阴极为碳素钢,电解废液可回收再利用。
①电解时NF3在______极生成;阴极产生的气体是______(填化学式)。
②电解后废液(含Ni少量Fe和Cu的单质及NH4HF2等)可经如下流程进行回收再利用:
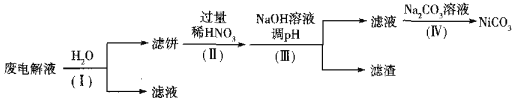
已知该实验条件下,部分金属离子开始沉淀与沉淀完全的pH如下表
金属离子 | Ni2+ | Fe2+ | Cu2+ | Fe3+ |
开始沉淀时的pH | 7.2 | 7.0 | 4.7 | 1.9 |
沉淀完全时的pH | 9.2 | 9.0 | 6.7 | 3.2 |
步骤I的目的是______;步骤Ⅱ滤饼中Ni溶于硝酸的离子方程式为______(HNO3的还原产物为NO);步骤Ⅲ调节pH时,理论上pH应控制的范围是______。