题目内容
【题目】利用下列实验探究亚硝酸钠(NaNO2)的化学性质。(AgNO2是淡黄色难溶于水的固体)
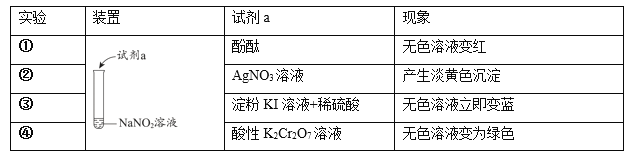
由上述实验所得结论不正确的是
A.NaNO2溶液呈碱性:NO2- +H2O![]() HNO2 +OH-
HNO2 +OH-
B.NaNO2可与某些盐发生复分解反应:NO2- + Ag+= AgNO2↓
C.NaNO2有氧化性:2I- + 2H+ + 2NO2-= I2 + 2NO2↑ + H2O
D.NaNO2有还原性:Cr2O72- + 3NO2-+ 8H+=3NO3- + 2Cr3+ + 4H2O
【答案】C
【解析】
A. 由实验①,NaNO2溶液加入酚酞溶液变红,说明溶液呈碱性,说明NaNO2属于强碱弱酸盐:NO2- +H2O![]() HNO2 +OH-,故A正确;
HNO2 +OH-,故A正确;
B. 由实验②,NaNO2溶液中加入硝酸银,产生淡黄色沉淀,说明可与某些盐发生复分解反应:NO2- + Ag+= AgNO2↓,故B正确;
C. 由实验③,NaNO2溶液中加入淀粉碘化钾溶液和硫酸溶液,溶液变蓝,说明碘离子变为碘单质使淀粉变蓝,碘元素由-1价变为0价做还原剂,则可证明NaNO2有氧化性,氮元素化合价应降低:2I-+ 2H+ + NO2-= I2 + NO↑ + H2O,故C错误;
D. 由实验④,NaNO2溶液中加入酸性重铬酸钾溶液,溶液变为浅绿色,说明生成+3价铬离子,铬元素由+6价变为+3价,化合价降低,重铬酸钾为氧化剂,则NaNO2为还原剂,说明NaNO2有还原性,发生的反应为:Cr2O72-+ 3NO2-+ 8H+=3NO3-+ 2Cr3+ + 4H2O,故D正确;
答案选C。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案【题目】N2O5是一种新型硝化剂,其性质和制备受到人们的关注。已知N2O5能与水发生反应,并放出大量的热。
Ⅰ.一定温度下,在恒容密闭容器中N2O5发生下列反应:2N2O5(g)![]() 4NO2(g)+O2(g)ΔH。
4NO2(g)+O2(g)ΔH。
(1)下表为反应在T1温度下的部分实验数据:
t/s | 0 | 500 | 1000 |
c(N2O5)/mol·L—1 | 5.00 | 3.52 | 2.48 |
则500s内NO2的生成速率为______________。
(2)反应达到平衡后,若再通入一定量N2O5,达到新平衡时,N2O5的转化率将______(填“增大”、“减小”、“不变”)。
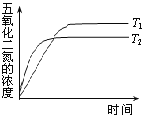
(3)在温度T1和T2时,N2O5的浓度与反应时间的关系如图所示。据此判断:T1______T2(填“>”、“<”或“=”,下同),ΔH______0。
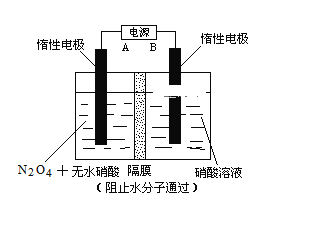
Ⅱ.下图所示装置,可用于制备N2O5气体。A是电源的____________(填“负极”或“正极”),电解池的阳极反应式为______________________________________________________。