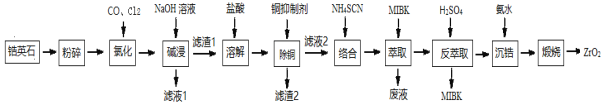
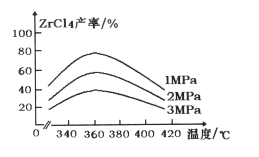
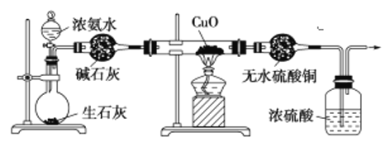
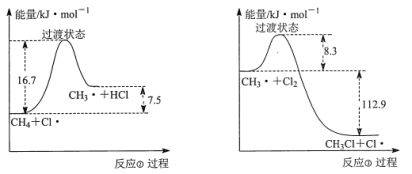
题目内容
【题目】(1)在粗制MgCl2晶体中常含有杂质Fe2+,在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质最好采用的是_________(填下面的选项),加入该氧化剂时,温度不能太高,原因是_________。
A.KMnO4 B.H2O2 C.HNO3 D.氯水
然后再加入适当物质调节溶液pH,可以达到除去Fe3+而不损失MgCl2的目的,调节溶液pH可选用下列中的有_________。
A.Mg2(OH)2CO3 B.MgO C.NH3·H2O D.Mg(OH)2
某溶液中含Mg2+和Fe3+,c(Mg2+)=0.02mol/L,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全,即溶液中c(Fe3+)=1.0×10-5mol/L,此时是否有Mg3(PO4)2沉淀生成?_________(FePO4、Mg3(PO4)2的Ksp分别为1.3×10-22、1.0×10-24)
(2)常温下Ksp[Fe(OH)3]=8.0×1038,Ksp[Cu(OH)2]=3.0×1020,通常认为残留在溶液中的离子浓度小于1×105molL1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0molL1,为除去溶液中的Fe3+而不影响Cu2+,溶液的pH的范围为_________。(已知lg5=0.7)。
(3)矿物中各种原生铜的硫化物经氧化、淋滤后可变成CuSO4溶液,并向内部渗透,遇到深层的闪锌矿(ZnS)和方铅矿(PbS),可慢慢转化为铜蓝(CuS)。写出硫酸铜与ZnS反应的离子方程式为:_________。
【答案】B H2O2受热时会分解 ABD 否 3.3~4 Cu2+(aq)+ZnS(s) CuS(s)+Zn2+(aq)
【解析】
(1)H2O2是绿色氧化剂,不会引入新的杂质且不产生大气污染物,KMnO4、HNO3、氯水都能氧化亚铁离子,但会引入新的杂质或产生大气污染,H2O2受热时会分解,然后再加入适当物质调节溶液pH,可以达到除去Fe3+而不损失MgCl2的目的,一般加要保留的物质的对应难溶物;某溶液中含Mg2+和Fe3+,先计算Fe3+恰好沉淀完全时溶液中c(PO43) = 1.3×1017,再计算此时Mg3(PO4)2的浓度商,与Ksp[Mg3(PO4)2]相比较。
(2)先计算除去溶液中的Fe3+的氢氧根离子浓度,再算氢离子浓度和pH,再计算Cu2+刚沉淀时的氢氧根离子浓度,再算氢离子浓度和pH。
(3)CuSO4溶液遇到深层的闪锌矿(ZnS)可慢慢转化为铜蓝(CuS)和锌离子。
(1)在粗制MgCl2晶体中常含有杂质Fe2+,在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,H2O2是绿色氧化剂,不会引入新的杂质且不产生大气污染物,KMnO4、HNO3、氯水都能氧化亚铁离子,但会引入新的杂质或产生大气污染,因此最好采用的是B,加入该氧化剂时,由于H2O2受热时会分解,因此使用时温度不能太高,避免降低利用率;然后再加入适当物质调节溶液pH,可以达到除去Fe3+而不损失MgCl2的目的,一般加要保留的物质的对应难溶物,利用水解原理,铁离子水解生成氢氧化铁和氢离子,氢离子与Mg2(OH)2CO3、MgO、Mg(OH)2反应,促进铁离子水解从而除去,而加入NH3·H2O会引入新的杂质,因此调节溶液pH可选用ABD;某溶液中含Mg2+和Fe3+,c(Mg2+)=0.02 molL1,加入双氧水和磷酸(设溶液体积增加1倍),使Fe3+恰好沉淀完全,即溶液中c(Fe3+)=1.0×10-5mol/L,Ksp(FePO4) = c(Fe3+)c(PO43) =1.0×105×c(PO43) = 1.3×1022,c(PO43) = 1.3×1017mol/L,此时Mg3(PO4)2浓度商为:c3(Mg2+)c2(PO43) =(0.01)3×(1.3×1017)2= 1.69×1040<1.0×10-24,因此无Mg3(PO4)2沉淀生成;故答案为:B;H2O2受热时会分解;ABD;否。
(2)常温下Ksp[Fe(OH)3]=8.0×1038,Ksp[Cu(OH)2]=3.0×1020,通常认为残留在溶液中的离子浓度小于1×105molL1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0molL1,为除去溶液中的Fe3+而不影响Cu2+,Ksp[Fe(OH)3]= c(Fe3+)c3(OH-)= 1×105×c3(OH-) = 8.0×1038,c(OH-) =2.0×1011 molL1,![]() ,pH = 4 lg5= 3.3;Ksp[Cu(OH)2]= c(Cu2+)c2(OH-)= 3×c2(OH-) = 3.0×1020,即Cu2+开始沉淀时c(OH-) =1.0×1010 molL1,
,pH = 4 lg5= 3.3;Ksp[Cu(OH)2]= c(Cu2+)c2(OH-)= 3×c2(OH-) = 3.0×1020,即Cu2+开始沉淀时c(OH-) =1.0×1010 molL1,![]() ,pH = 4,因此溶液的pH的范围为3.3~4之间;故答案为:3.3~4。
,pH = 4,因此溶液的pH的范围为3.3~4之间;故答案为:3.3~4。
(3)矿物中各种原生铜的硫化物经氧化、淋滤后可变成CuSO4溶液,并向内部渗透,遇到深层的闪锌矿(ZnS)和方铅矿(PbS),可慢慢转化为铜蓝(CuS),则硫酸铜与ZnS反应的离子方程式为:Cu2+(aq)+ZnS(s) CuS(s)+Zn2+(aq);故答案为:Cu2+(aq)+ZnS(s) CuS(s)+Zn2+(aq)。

 阅读快车系列答案
阅读快车系列答案